
| A. | 2H2(g)+O2(g)═2H2O(l)△H1 2H2(g)+O2(g)═2H2O(g)△H2 | |
| B. | S(g)+O2(g)═SO2 (g)△H1 S(s)+O2(g)═SO2 (g)△H2 | |
| C. | C(s)+O2(g)═CO(g)△H1 C(s)+O2(g)═CO2(g)△H2 | |
| D. | HCl(g)═H2(g)+Cl2(g)△H1 2HCl(g)═H2(g)+Cl2(g)△H2 |
分析 A.反应物相同,生成物中气态水比液态水的能量高,且燃烧为放热反应;
B.生成物相同,反应物中气态硫比固态硫的能量高,且为放热反应;
C.完全燃烧放出的热量多;
D.为吸热反应,物质的量与热量成正比.
解答 解:A.反应物相同,生成物中气态水比液态水的能量高,且燃烧为放热反应,则前者放出热量多,可知△H1<△H2,故A错误;
B.生成物相同,反应物中气态硫比固态硫的能量高,且为放热反应,则前者放出热量多,可知△H1<△H2,故B错误;
C.完全燃烧放出的热量多,则后者放出的热量多,可知△H1>△H2,故C正确;
D.为吸热反应,物质的量与热量成正比,则后者吸收能量高,可知△H1<△H2,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、焓变的正负为解答的关键,侧重分析与应用能力的考查,注意Q与△H的关系,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | SiO2是酸性氧化物不跟任何酸反应 | |
| B. | 水玻璃敞口存放,能有白色胶状沉淀析出 | |
| C. | 高温时SiO2能跟Na2CO3反应放出CO2,所以硅酸的酸性比碳酸强 | |
| D. | SiO2和CO2化学性质虽然相似,且两者的结构完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
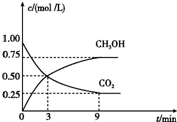 中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
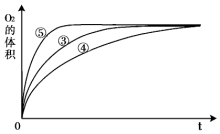 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol羟基与1mol氢氧根离子所含有的电子数目均为9NA | |
| B. | 电解饱和食盐水,当阴极产生2.24L气体时,转移的电子数为0.2NA | |
| C. | 7.8gNa2O2和Na2S的混合物中含有的离子总数为0.7NA | |
| D. | 常温下,1L0.1mol/LNa2CO3溶液中,含有离子的总数大于0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com