
【题目】按要求回答下列问题:
(1)如图所示物质的有关结构,请回答:
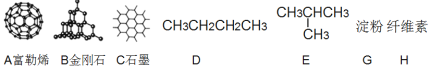
①A、B、C三者的关系为_________(填写序号)。
a.同分异构体b.同素异形体c.同一种物质d.同位素
②固态时,A属于__________晶体(填“离子”、“原子”或“分子”)。
③有同学认为D、E互为同分异构体而G、H两者并不是同分异构体的关系。这句话正确吗?答:__________(填写“正确”或“不正确”)
④有机物E用系统命名法命名的名称是__________。
(2)已知下列7种物质:a.P4(白磷) b.SiO2 c.NH4Cl d.NaOH e.NaCl f.干冰 g.金刚石,固态时它们都为晶体,回答下列问题:(填写序号)
①晶体中既有离子键又有共价键的是__________
②熔化时只需要破坏共价键的是__________
③熔点最高的晶体是__________,沸点最低的晶体是__________
【答案】b 分子 正确 2-甲基丙烷 cd bg g f
【解析】
由同种元素构成的不同种分子互称为同素异形体;由分子构成的晶体叫做分子晶体;分子式相同而结构不同的两种化合物互称为同分异构体;原子晶体的熔沸点最高,离子晶体次之,分子晶体的熔沸点最低。
(1)①ABC均是有C元素构成的物质,三者互称同素异形体,b正确;
②A为富勒烯,是分子,故晶体类型为分子晶体;
③DE分子式相同而结构不同,二者互称同分异构体,但是GH二者分子式不同,故不能互称同分异构体;
④选择最长碳链为主链,分子中最长碳链为3个碳,为丙烷,其中二号碳上存在一个支链,故E物质的系统命名为2-甲基丙烷;
(2)a.P4(白磷)由白磷分子构成,为分子晶体;b.SiO2由Si和O以共价键形式结合,为原子晶体;c.NH4Cl由离子键构成,铵根离子中存在共价键,氯化铵为离子晶体;d.NaOH由离子键构成,氢氧根中存在共价键,氢氧化钠为离子晶体;e.NaCl存在离子键,为离子晶体;f.干冰由二氧化碳分子构成,为分子晶体;g.金刚石,由碳以共价键形式结合,为原子晶体;
①根据上述分析,晶体中既有离子键又有共价键的是cd;
②根据上述分析,熔化时只需要破坏共价键的是bg;
③晶体中原子晶体的熔点相对于其他晶体来说为最高,由于金刚石中C-C键的键长较Si-O键的键长短,因此C-C键的键能较大,金刚石的熔点较SiO2的熔点高,故熔点最高的晶体是g;晶体中分子晶体沸腾时只需要克服分子间作用力,而分子间作用力相对其他粒子间的相互作用小得多,,故分子晶体的沸点为晶体中最低,白磷和二氧化碳均为分子晶体,但常温下白磷为固体,二氧化碳为气体,故沸点最低的晶体是f。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某温度下,在一固定容积的密闭容器中进行反应:A2 +B2![]() 2AB。该条件下,A2、B2、AB均为气体。下列情况一定能说明该反应已达到化学平衡状态的是( )
2AB。该条件下,A2、B2、AB均为气体。下列情况一定能说明该反应已达到化学平衡状态的是( )
A. 气体的密度不再改变时
B. 气体的总物质的量不再改变时
C. 混合气体中各组分的含量不再改变时
D. 每消耗1molB2同时有2molAB生成时
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将4molNH3和4molO2混合于固定容积为2L的密闭容器中,发生反应:4NH3(g)+5O2(g)=4X(g)+6H2O(g)。2min后该反应达到平衡,生成3molH2O。则:
(1)X的化学式为___。
(2)O2的转化率为___(O2转化率=已反应的O2的量/O2的总量×100%)。
(3)0~2min内,v(NH3)=___mol·L-1·min-1。
(4)燃料电池是一种高效、环境友好型发电装置。一种燃料电池的电解质溶液为NaOH溶液,负极通入NH3,正极通入空气,产物对环境无污染,则负极的电极反应式为___,电路中每通过1mol电子,消耗标准状况下的空气___(假设空气中O2的含量为20%)L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g) →Fe(s)+CO2(g)-Q,已知1100℃时,K=0.263
(1)写出该反应的平衡常数表达式____。温度升高,化学平衡移动后达到新的平衡,高炉中CO2和CO的体积比值___,平衡常数K值___(以上选填“增大”、“减小”或“不变”)。
(2)1100℃时测得高炉中c(CO2)=0025mol/L、c(CO)=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态___(选填“是”或“否”),此时,化学反应速率是v正___v逆(选填“大于”、“小于”或“等于”),其原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一混合物的水溶液,只可能含有以下离子中的若干种:K+、![]() 、Cl-、Mg2+、Ba2+、
、Cl-、Mg2+、Ba2+、![]() 、
、![]() ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生;
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol;
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测不正确的是
A.K+不一定存在B.100mL溶液中含0.02mol![]()
C.Cl-不一定存在D.Ba2+、Mg2+不存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中:互为同分异构体的是___,互为同系物的是__,属于同一种物质的是___。
A.CH3CH2CH3、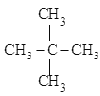 B.CH3-CH=CH-CH3、CH2=CH-CH2-CH3 C.CH2=CH-CH3、C2H4 D.
B.CH3-CH=CH-CH3、CH2=CH-CH2-CH3 C.CH2=CH-CH3、C2H4 D.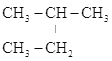 、
、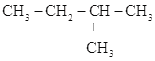 E.CH3CH2CH2COOH、CH3COOCH2CH3
E.CH3CH2CH2COOH、CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,水既不是氧化剂又不是还原剂的是( )
A.C+H2O═CO+H2
B.2Na2O2+2H2O═2NaOH+O2↑
C.2Na+2H2O═2NaOH+H2↑
D.2F2+2H2O═4HF+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将28L HCl气体溶液在水中配成250mL盐酸溶液
(1)求所得盐酸的物质的量浓度;
(2)若取此溶液50mL再稀释成1L溶液,求稀释后盐酸的物质的量浓度;
(3)若用KMnO4氧化该盐酸溶液制氯气,反应方程式如下:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,
若产生的Cl2在标准状况下的体积为672mL,则被氧化的HCl的物质的量.(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面对SO2和CO2的描述正确的是
A. SO2为原子晶体,CO2为分子晶体
B. 中心原子采取的杂化方式:SO2为sp2杂化,CO2为sp杂化
C. 都是直线形结构
D. S原子和C原子上都没有孤电子对
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com