

| A、烃的衍生物 | B、高分子化合物 |
| C、无机物 | D、烃 |
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
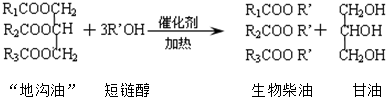
| A、“地沟油”主要成分是高级脂肪酸的甘油酯 |
| B、生物柴油是不同酯组成的混合物 |
| C、生物柴油属于化石燃料 |
| D、“地沟油”可用于制备生物柴油 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.4 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.4 mol?L-1?s-1 |
| D、0.2 mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硝酸工业的尾气常用NaOH溶液来处理 |
| B、硫酸工业的尾气常用氨水来处理 |
| C、可用蘸浓氨水的棉棒检验输送氯气的管道是否漏气 |
| D、碘是人体必需微量元素,所以要多吃富含高碘酸的食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢键属于化学键,但比较弱 |
| B、任何物质中都一定含有化学键 |
| C、NaOH中有离子键和共价键,则NaOH既属于离子化合物,又属于共价化合物 |
| D、H2O2中既有极性键,又有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol?L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
| CH4 | CO
|
C2O
|
|||||||||
NH
|
N2H
|
NO
|
N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
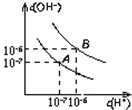 已知水在25℃和100℃时,其电离平衡曲线如图所示:
已知水在25℃和100℃时,其电离平衡曲线如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com