
【题目】
(1)根据反应8NH3+3Cl2=6NH4Cl+N2 , 回答下列问题:
①该反应中氧化剂是 , 氧化产物是。
②该反应中被氧化的物质与被还原的物质物质的量之比为。
(2)某一反应体系中存在下列6种物质:NO、FeSO4、Fe(NO3)3、HNO3、Fe2(SO4)3和H2O。已知存在下列转化关系:HNO3→NO,请完成下列各题:
①该反应的氧化剂是 , 还原剂是。
②该反应中1 mol氧化剂(填“得到”或“失去”)mol电子。
③当有0.1 mol HNO3被还原,此时生成标准状况下NO的体积是L。
④请把各物质填在下面空格处,需配平:
+□=□+□+□+□
【答案】
(1)Cl2,N2,2∶3
(2)HNO3,FeSO4,得到,3,2.24,4HNO3,3FeSO4,Fe(NO3)3,Fe2(SO4)3,NO↑,2H2O
【解析】(1)①在氧化还原反应8NH3+3Cl2=6NH4Cl+N2中,氮元素化合价升高,被氧化,NH3作还原剂,N2是氧化产物;氯元素化合价降低,被还原,作氧化剂,NH4Cl是还原产物;故该反应的氧化剂是Cl2,还原剂是NH3;②若有8 mol NH3参与反应,则2 mol NH3被氧化,3 mol Cl2被还原,因此该反应中被氧化的物质与被还原的物质物质的量之比为2∶3;③氮元素失去6 mol e,氯元素得到6 mol e,故单线桥从氮元素出发,到氯元素终止,据此利用单线桥法标出电子转移的方向和数目。
(2)①由于反应中存在转化关系:HNO3→NO,因此氮元素化合价降低,被还原,HNO3为氧化剂,NO为还原产物;因此铁元素一定是化合价升高,被氧化,FeSO4是还原剂,Fe(NO3)3和Fe2(SO4)3是氧化产物;故该反应的氧化剂是HNO3,还原剂是FeSO4;②1 mol氧化剂得到3 mol e;③当有0.1 mol HNO3被还原,根据原子守恒可知,生成NO的物质的量为0.1 mol,标准状况下的体积为 ![]() ;④根据得失电子守恒,并结合原子守恒,可以配平化学方程式:4HNO3+3FeSO4=Fe(NO3)3+Fe2(SO4)3+NO↑+2H2O 。
;④根据得失电子守恒,并结合原子守恒,可以配平化学方程式:4HNO3+3FeSO4=Fe(NO3)3+Fe2(SO4)3+NO↑+2H2O 。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】用等体积的0.15mol L﹣1的BaCl2溶液,可使相同体积的Na2SO4、Fe2(SO4)3、KAl(SO4)2三种溶液中的SO42﹣完全沉淀,则三种硫酸盐的物质的量浓度之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+ , 他们使用的药品和装置如图所示:其中下列说法不合理的是( ) 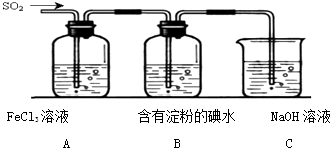
A.能表明I﹣的还原性弱于SO2的现象是B中蓝色溶液褪色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2 , 产生白色沉淀
D.为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是( )
A.纯碱可用于去除餐具的油污
B.“火树银花”中的焰火实质上是金属元素的焰色反应
C.碳酸钡可用于胃肠X射线造影检查
D.煤经过气化、液化等化学变化过程,可以转化为清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期表的叙述正确的是()
A. 每一周期的元素都是从金属开始,最后以稀有气体结束
B. 元素周期表中有18个纵行,共有18个族
C. ⅠB~ⅧB族是副族元素,完全由长周期元素构成
D. 第2、3周期同主族上下相邻元素的原子核外电子数相差8个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)26H2O的流程如图1: 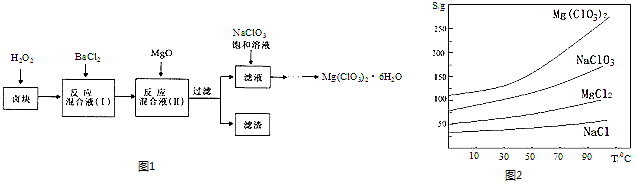
已知:①卤块主要成分为MgCl26H2O,含有MgSO4、FeCl2等杂质.
②四种化合物的溶解度(S)随温度(T)
变化曲线如图2所示.回答下列问题:
(1)过滤时主要的玻璃仪器有 .
(2)加入BaCl2的目的是除去杂质离子,检验已沉淀完全的方法是 .
(3)加速卤块在H2O2溶液中溶解的措施有:(写出一条即可)
(4)加入MgO的作用是; 滤渣的主要成分为 .
(5)向滤液中加入NaClO3饱和溶液后,发生反应的化学方程式为:MgCl2+2NaClO3=Mg(ClO3)2↓+2NaCl,再进一步制取Mg(ClO3)26H2O的实验步骤依次为①;②趁热过滤;③;④过滤、洗涤、干燥.
(6)产品中Mg(ClO3)26H2O含量的测定: 步骤1:准确称量3.50g产品配成100mL溶液.
步骤2:取10.00mL于锥形瓶中,加入10.00mL稀硫酸和20.00mL 1.000molL﹣1的FeSO4溶液,微热.
步骤3:冷却至室温,用0.l000molL﹣1K2Cr2O7溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O72﹣+6Fe2++14H+=2Cr3++6Fe3++7H2O.
步骤4:将步骤2、3重复两次,计算得平均消耗K2Cr2O7溶液15.00mL.
①请写出步骤2中发生反应的离子方程式(还原产物为Cl﹣)
②产品中Mg(ClO3)26H2O的质量分数为 . (计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )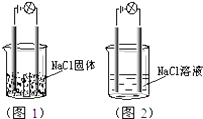
A.NaCl是非电解质
B.NaCl溶液是电解质
C.NaCl溶液中水电离出大量的离子
D.NaCl在水溶液中电离出了可以自由移动的离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气在工农业生产中有非常重要的应用.
(1)工业上常用氨气和醋酸二氨和铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO﹣简写为Ac﹣).反应方程式为:[Cu(NH3)2]Ac+CO+NH3[Cu(NH3)3CO]Ac ①请写出基态Cu原子的电子排布式 .
②氨水溶液中各元素原子的电负性从大到小排列顺序为 .
③醋酸分子中的两个碳原子,甲基(﹣CH3)碳和羧基(﹣COOH)碳的杂化方式分别是 .
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有 .
a.离子键 b.配位键 c.σ键 d.π键
(2)如图为一个金属铜的晶胞,请完成以下各题. ①铜原子采取的这种堆积方式的空间利用率为 . (填数值)
②此晶胞立方体的边长为acm,Cu的相对原子质量为64.若阿伏伽德罗常数为NA , 则金属铜的晶体密度ρ为g/cm3 . (用a、NA表示).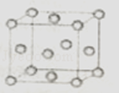
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础,关于下列各实验装置图的叙述中,错误的是( )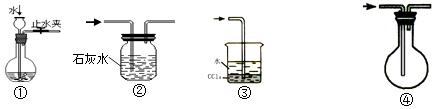
A.装置①可用于检查装置的气密性
B.装置②可用于除去CO中混有的少量CO2
C.装置③可用于安全吸收极易溶于水的氯化氢来制盐酸
D.装置④可用于排空气收集CO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com