
欲配制500 mL 0.2 mol/L的碳酸钠溶液,回答下列问题:
(1)通过计算可知,应用托盘天平称取________g碳酸钠。
(2)称量的操作顺序为________(填选项字母)。
A.调天平零点 B.游码归零 C.向小烧杯中加碳酸钠 D.称量空烧杯 E.向右盘加砝码并将游码移到所需位置 F.将砝码归盒 G.记录称量结果
(3)若砝码和药品位置放颠倒(假设称量时未用烧杯),天平平衡时,实际称量碳酸钠的质量是________。
(4)下列操作使所配溶液浓度偏高的是________。
A.称取28.6 g Na2CO3·10H2O进行配制
B.称量时用了生锈的砝码
C.往容量瓶转移溶液时,有少量液体溅出
D.碳酸钠中含有不溶性杂质
E.未洗涤溶解Na2CO3的烧杯
F.定容时仰视刻度线
G.小烧杯洗净后未干燥即用来称量
H.容量瓶未干燥即用来配制溶液。
解析 (1)n(Na2CO3)=c·V=0.2 mol·L-1×0.5 L=0.1 mol,m(Na2CO3)=n(Na2CO3)·M(Na2CO3)=0.1 mol×106 g·mol-1=10.6 g。配制时用Na2CO3·10H2O,则需称取的固体质量为28.6 g。
(2)用托盘天平称量已知质量的物质,其称量顺序为:①调天平:游码归零(B),调天平零点(A);②称空烧杯(D)[因Na2CO3为碱性化合物],记录结果(G);③称烧杯+药品:根据所称药品的质量和空烧杯的质量向天平上加砝码和游码(E),再向烧杯中加Na2CO3至天平平衡(C);
④称量结束,将砝码归盒(F),游码归零(B),将天平放回盒中保存。
(4)B项中因砝码生锈,砝码成分之一的铁(Fe)在空气中氧化生成铁锈(Fe2O3·nH2O),使砝码质量增加,最终导致所配溶液浓度偏大。
答案 (1)10.6
(2)BADGECFB
(3)9.4 g
(4)B


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
下列离子方程式不正确的是( )
A.向硅酸钠溶液中通入少量CO2气体 SiO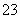 +CO2+H2O===
+CO2+H2O===
H2SiO3↓+CO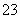
B.将Cu片插入FeCl3溶液中 Cu+Fe3+===Fe2++Cu2+
C.向烧碱溶液中滴加少量Al2(SO4)3溶液 Al3++4OH-===
[Al(OH)4]-
D.将Ag丝插入NaNO3和H2SO4的混合液中 3Ag+4H++NO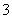 ===3Ag++NO↑+2H2O
===3Ag++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.从海带中提取碘单质的过程涉及氧化还原反应
B.往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输
C.赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的
D.海洋经济专属区的资源开发可获得Fe、Co、K、Au、B等金属
查看答案和解析>>
科目:高中化学 来源: 题型:
50 g浓度为c mol·L-1,密度为ρ g·cm-3的氨水中加入一定量的水稀释成0.5c mol·L-1,则加入水的体积为( )
A.小于50 mL B.等于50 mL
C.大于50 mL D.等于50/ρ mL
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
|
| A. | 稀硫酸不具有氧化性 |
|
| B. | NH4Cl中只含有离子键 |
|
| C. | 可用丁达尔效应区分溶液和胶体 |
|
| D. | 金属阳离子被还原时一定得到金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室保存下列试剂的方法不正确的是( )
|
| A. | 钠保存在煤油中 |
|
| B. | 用棕色试剂瓶盛放新制的氯 |
|
| C. | 用带玻璃塞的试剂瓶盛放NaOH溶液 |
|
| D. | 向盛放氯化亚铁溶液的试剂瓶中加少量铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况.
| 步骤 | 操作 | 现象 |
| I | 向2mL 1mol•L﹣1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, 并有少量刺激性气味的气体逸出 |
(1)常温下,FeCl3溶液的pH 7(填“<”、“>”或“=”).
(2)分析红褐色产生的原因.
①甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因: .
②乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
□Fe3++□SO32﹣+□ ═□Fe2+□ +□
乙同学查阅资料得知:
| 1.Fe2+与SO32﹣反应生成墨绿色的絮状沉淀FeSO3; 2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色. |
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成如下实验:
| 步骤 | 操作 | 现象 |
| Ⅱ | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3.而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是 .
(4)进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成如下实验:
| 步骤 | 操作 | 现象 |
| Ⅲ | 向1mol•L﹣1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| Ⅳ | 用激光笔照射步骤Ⅲ中的红褐色溶液 | 没有出现“丁达尔效应” |
①经检验步骤III中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是 (填字母).
a.K3[Fe(CN)6]溶液 b.KSCN溶液 c.KMnO4溶液
②已知H2SO3是弱酸,请结合电离方程式说明步骤Ⅲ中出现红褐色的原因: .
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确.
查看答案和解析>>
科目:高中化学 来源: 题型:
某质检员将甲、乙、丙三种衣料做纤维检验,所得结果如下表:
| 甲 | 乙 | 丙 | |
| 靠近火焰 | 稍微卷缩 | 无变化 | 尖端熔成小球 |
| 燃烧的气味 | 有特殊气味 | 无异味 | 有味 |
| 热塑性 | 无 | 无 | 良好 |
检验甲、乙、丙三种衣料纤维后得出的最佳结论是( )
A.甲为棉、乙为丝,丙为涤纶
B.甲为丝、乙为棉,丙为腈纶
C.甲为腈纶、乙为丝,丙为棉
D.甲为棉、乙为维尼纶,丙为丝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com