
| A. | Al2O3固体不导电且难溶于水,所以Al2O3不是电解质 | |
| B. | Na2SO4溶液导电,所以Na2SO4是电解质 | |
| C. | 纯净的硫酸不导电,所以硫酸不是电解质 | |
| D. | 1.5mol/L的NaCl溶液与1.0mol/L的MgCl2溶液相比较,导电能力后者强 |
分析 A.在水溶液里或熔融状态下能导电的化合物是电解质;
B.电解质必需是化合物;
C.在水溶液里或熔融状态下能导电的化合物是电解质;
D.导电能力和离子浓度和所带电荷有关.
解答 解:A.在水溶液里或熔融状态下能导电的化合物是电解质,Al2O3固体不导电但熔融状态下能导电,所以Al2O3是电解质,故A错误;
B.电解质必需是化合物,Na2SO4溶液是混合物,不是电解质,故B错误;
C.在水溶液里或熔融状态下能导电的化合物是电解质,纯净的硫酸不导电但水溶液中能导电,所以硫酸是电解质,故C错误;
D.导电能力和离子浓度和所带电荷有关,1.5mol/L的NaCl溶液与1.0mol/L的MgCl2溶液相比较离子总浓度都为3mol/L,但镁离子所带电荷多,故导电能力强,故D正确;
故选D.
点评 本题考查了电解质的概念,难度不大,注意电解质首先必须是化合物,单质和混合物既不是电解质也不是非电解质.


科目:高中化学 来源: 题型:解答题
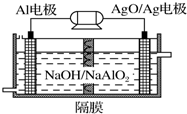 铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛.
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O═4Fe3++4OH- | |
| B. | 以金属银为阳极电解饱和硫酸铜溶液:Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | Ca(ClO)2溶液中通入过量的SO2气体:ClO-+SO2+H2O═HClO+HSO3- | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2 MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油不能使溴水褪色 | |
| B. | 淀粉水解的最终产物是葡萄糖 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 蛋白质遇到硫酸铜后产生的沉淀能重新溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
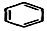 +H2C═CH2$\stackrel{一定条件}{→}$
+H2C═CH2$\stackrel{一定条件}{→}$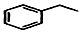
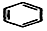 +2H2C═CH2$\stackrel{一定条件}{→}$
+2H2C═CH2$\stackrel{一定条件}{→}$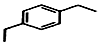
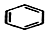 +2H2C═CH2$\stackrel{一定条件}{→}$
+2H2C═CH2$\stackrel{一定条件}{→}$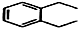
 .
.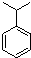 . N:
. N: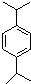 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com