
【题目】现有下列物质:① N2 ②Na2O2 ③NaOH ④HCl ⑤H2O2 ⑥MgF2 ⑦NH4Cl。
(1)只由非极性键构成的物质是__________________(填编号)。
(2)由离子键和极性键构成的物质是_______________。
(3)⑤H2O2的电子式为:_________________。
(4)用电子式表示⑥MgF2的形成过程:______________。
(5)下列说法不正确的是________。
①共价化合物中含共价键,也可能含离子键
②因为H2CO3酸性<H2SO3酸性,所以非金属性C<S
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤熔融状态能导电的物质是离子化合物
⑥由分子组成的化合物中一定存在共价键
A. ①③⑤ B. ①②⑥ C. ①②④⑤ D. ①③⑤⑥
【答案】① ③⑦ ![]()
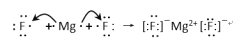 C
C
【解析】
(1)同种元素形成的共价键为非极性键,所以只由非极性键构成的物质是① N2,故答案为:①;
(2)阴阳离子之间形成离子键,不同种元素形成的共价键为极性键,所以由离子键和极性键构成的物质是③NaOH和⑦NH4Cl,故答案为:③⑦;
(3)H2O2是共价化合物,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)镁原子失去两个电子形成镁离子,两个氟原子各得一个电子形成氟离子,镁离子和氟离子构成MgF2,其形成过程为: ,故答案为:
,故答案为: ;
;
(5)①只含共价键的化合物是共价化合物,共价化合物中一定不含离子键,故错误;
②H2SO3不是S最高价氧化物对应的水化物,无法比较出非金属性C<S,故错误;
③含金属元素的化合物不一定是离子化合物,可能是共价化合物,如氯化铝,故正确;
④由非金属元素组成的化合物不一定是共价化合物,可能是离子化合物,如铵盐,故错误;
⑤熔融状态能导电的物质是不一定为离子化合物,如金属单质,故错误;
⑥由分子组成的物质中不一定存在共价键,如稀有气体,但由分子组成的化合物中一定存在共价键,故正确;
综上,错误的为①②④⑤,符合条件的为C,故答案为:C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一种镁-过氧化氢燃料电池的原理为Mg + H2O2 + H2SO4=MgSO4+ 2H2O ,其装置如图所示。下列说法错误的是
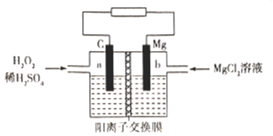
A.a极发生还原反应B.电子由b极经电解质溶液流向a极
C.Mg2+由右侧经过阳离子交换膜移向左侧D.b极电极反应式为Mg-2e-=Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制铵明矾晶体的工艺流程如图所示:
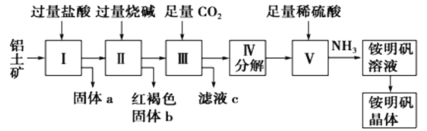
请回答下列问题:
(1)固体a的化学式为___,固体b化学式为___,Ⅲ中通入足量CO2气体发生反应的离子方程式为___。
(2)由Ⅴ制取铵明矾溶液的化学方程式为___。
(3)由I→II→III→IV都要用到的分离方法是___,由铵明矾溶液中制铵明矾晶体的操作是___,___,过滤,洗涤,干燥保存。
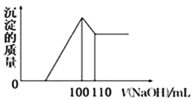
(4)向10gFe2O3、SiO2和Al2O3的混合物中,加入100mL稀硫酸,过滤后,向滤液中加入10mol/LNaOH溶液,产生沉淀的质量和加入NaOH溶液体积的关系曲线如图所示。则混合物中三氧化二铝的质量分数为___。
(5)有一种含铁、硅等元素的矿石,其主要成分的化学式为Na2Fe5(OH)2Si8O22,该物质中+2价铁与+3价铁的物质的量之比为___。将mg该矿石用足量的酸溶解后,加入过量铜粉使溶液中的铁元素全部变为Fe2+,过滤后滤液用cmol/L的KMnO4酸性溶液与Fe2+反应,用去VmL溶液。该矿石中铁元素的质量分数为___(用含m、c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种常用金属,工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO 等)湿法制取金属锌的流程如图所示,回答下列问题。

已知:Fe的活泼性强于Ni。
(1)ZnFe2O4可写成ZnOFe2O3,则ZnFe2O4与H2SO4反应的化学方程式___。
(2)“净化Ⅰ”操作分为两步:
①将溶液中少量的 Fe2+氧化,下列试剂中可选用的是_____(填字母标号)。
A.新制氯水 B.30 % H2O2溶液 C.FeC13溶液 D.KMnO4溶液
②加入ZnO,调节溶液pH为3.3~6.7;加热到60℃左右并不断搅拌,加热搅拌主要目的是___。
(3)“净化Ⅰ”生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____。
(4)“净化Ⅱ”中加入过量Zn的目的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )

A. 上下移动①中铜丝可控制SO2的量
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1 molL-1CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 用惰性电极电解MgCl2溶液,电解的离子方程式为: 2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C. 向盐酸中加入氨水至中性,溶液中c(NH4+)/c(Cl-)>1
D. 将AgCl与AgBr的饱和溶液等体积混合,再加入足量AgNO3溶液,生成的沉淀AgCl多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足表中图示物质在一定条件下,一步转化关系的组合有( )
序号 | X | Y | Z | W |
|
① | Si | Na2SiO3 | H2SiO3 | SiO2 | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A.①②③B.①③C.②③D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示阴阳膜组合电解装置用于循环脱硫,用NaOH溶液在反应池中吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解又制得NaOH。其中a、b离子交换膜将电解槽分为三个区域,电极材料为石墨,产品C为H2SO4溶液。下列说法正确的是( )

A. b为只允许阳离子通过的离子交换膜
B. 阴极区中B最初充入稀NaOH溶液,产品E为氧气
C. 反应池采用气、液逆流方式,目的是使反应更充分
D. 阳极的电极反应式为SO32-+2e-+H2O===2H++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型)。
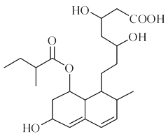
下列关于普伐他汀的性质描述正确的是 ( )
A. 能与FeCl3溶液发生显色反应
B. 该物质的分子式为C23H38O7
C. 能发生加成、取代、消去反应,能使酸性KMnO4溶液褪色
D. 1mol该物质最多可与1molNaOH反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com