
| A. | 乙烯的化学性质比乙烷活泼 | B. | 乙烯的比例模型可表示为  | ||
| C. | 可作香蕉等水果的催熟剂 | D. | 燃烧时火焰明亮,同时产生黑烟 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
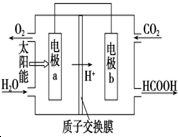 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途. | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | XZ线上任意点均呈中性,pH=7 | |
| B. | 两条曲线间任意点均有c(H+)•c(OH-)=Kw | |
| C. | M区域内任意点均有c(H+)<c(OH-) | |
| D. | 图中T1<T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 含有5种官能团 | |
| B. | 分子式为C9H9O6 | |
| C. | 可以发生取代、加成、消去、氧化反应 | |
| D. | 核磁共振氢谱具有6个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然纤维和合成纤维的主要成分都是纤维素 | |
| B. | 海水淡化的方法有蒸馏法、离子交换法和电渗析法等 | |
| C. | 用乙醚从黄花蒿中提取青蒿素利用了萃取原理 | |
| D. | 水泥厂常用高压电除去工厂烟尘,利用了胶体的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
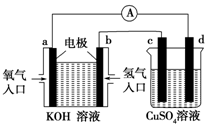 (1)用作橡胶工业的硫化剂S2Cl2的分子结构中每个原子均满足8电子稳定结构,①试写出S2Cl2的电子式
(1)用作橡胶工业的硫化剂S2Cl2的分子结构中每个原子均满足8电子稳定结构,①试写出S2Cl2的电子式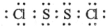 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
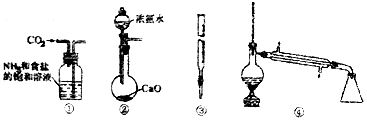
| A. | 装置①可用于模拟侯氏制碱法制取碳酸氢钠 | |
| B. | 装置②可用于制备少量NH3 | |
| C. | 装置③可用于准确取一定体积酸性KMnO4标准溶液 | |
| D. | 装置④常用于分离互不相溶的液体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 将铜丝插入浓硝酸中:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 将过氧化钠投入足量水中:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| D. | (NH4)2Fe(SO4)2溶液与过量Ba(OH)2溶液混合:Fe2++2SO42-+2Ba2++2OH-═Fe(OH)2↓+2BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com