
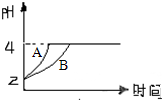
 (1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.则该溶液呈
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.则该溶液呈

科目:高中化学 来源: 题型:
| A、NH4HCO3溶液中加入过量稀NaOH溶液:NH4++OH-=NH3?H2O |
| B、FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| C、硫酸亚铁溶液中加入用硫酸酸化的双氧水:Fe2++2H++H2O2=Fe3++2H2O |
| D、足量AlCl3溶液与小苏打溶液混合:Al3++3HCO3-=Al(OH)3↓+3CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
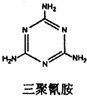 “问题胶囊”事件引发了各方关注和热议,国际食品包装协会秘书长董金狮教授说:“工业明胶中重金属铬的毒性远高于三聚氰胺”.铬是严重的致癌物质,绝不允许含铬废水随意排放.请回答下列问题:
“问题胶囊”事件引发了各方关注和热议,国际食品包装协会秘书长董金狮教授说:“工业明胶中重金属铬的毒性远高于三聚氰胺”.铬是严重的致癌物质,绝不允许含铬废水随意排放.请回答下列问题: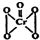 ,该反应可用来检验Cr2072-的存在.过氧化铬中铬元素的化合价为
,该反应可用来检验Cr2072-的存在.过氧化铬中铬元素的化合价为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图1连接.
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图1连接.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向0.1mol/L的Na2S溶液中加入Agl(s)+S2-?Ag2S(s)+2I- | ||
| B、碳酸钠溶液显碱性的原因:CO32-+2H2O?H2CO3+2OH- | ||
C、一氧化硫通入氯化铁溶液:SO2+Fe3++2H2O═SO
| ||
| D、用醋酸清洗盛放石灰水试剂瓶内壁出现的白色固体:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com