
分析 (1)①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=-24.5kJ•mol-1,①×2+②得,2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)△H=-122.5kJ•mol-1,据此进行分析;
(2)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,题干所给量计算32g甲醇燃烧生成二氧化碳和液态水放热,结合热化学方程式书写方法,标注物质聚集状态和对应焓变;
(3)①根据电子转移守恒计算消耗氧气;
②甲醇和NO3-反应转化为两种无毒气体,应是生成N2、CO2,反应还生成水.
解答 解:(1)①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=-24.5kJ•mol-1,①×2+②得,2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)△H=-122.5kJ•mol-1,
故答案为:-122.5;
(2)在25℃、101kPa下,1.6g液态甲醇完全燃烧,当恢复到原状态时,放出36.29kJ的热量,则32g甲醇燃烧生成二氧化碳和液态水放出热量为725.8KJ;则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ•mol-1;
(3)①1g铵态氮元素物质的量为$\frac{1g}{14g/mol}$=$\frac{1}{14}$mol,根据电子转移守恒,转化为硝态氮元素时需氧的物质的量为$\frac{\frac{1}{14}mol×[5-(-3)]}{4}$=$\frac{1}{7}$mol,需要氧气质量为$\frac{1}{7}$mol×32g/mol≈4.6g,
故答案为:4.6;
②甲醇和NO3-反应转化为两种无毒气体,应是生成N2、CO2,反应还生成水,反应离子方程式为:6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O,
故答案为:6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O.
点评 本题比较综合,涉及反应热计算、燃烧热化学方程式的书写、电极反应式书写、氧化还原反应计算等,是对学生综合能力考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 分子式为C4H8的物质性质均与2-丁烯相同 | |
| B. | 氧化性:O3>O2 | |
| C. | 常温常压下,22.4L的2-丁烯中含C-H键数目为8×6.02×1023个 | |
| D. | 1molO3参与该反应,转移的电子数为6×6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
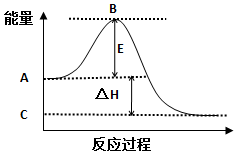
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
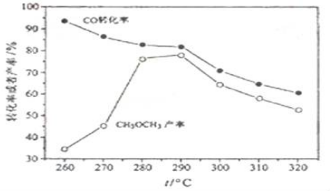 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过程的自发性只能用于判断过程的方向性,不能确定过程是否一定会发生和过程发生的速率 | |
| B. | 空气污染日报中的空气污染指数的主要项日有可吸入颗粒物、二氧化硫、二氧化氮 | |
| C. | 金属冶炼过程主要是利用金属矿物中的金属离子失去电子变成金属单质所发生的氧化还原反应 | |
| D. | 糖类和油脂是重要的基本营养物质,并且是人体所需能量的重要来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
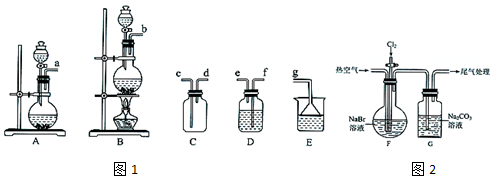
| 操作步骤 | 实验现象 | 结论或解释 |
| ①去适量G中溶液于试管中,加入硫酸酸化 | 产生气泡 | G中溶液含有CO32-或HCO3- |
| 向①的试管中加入CCl4,振荡,静置 | ②溶液分层,下层为棕红色 | 生成单质溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀硝酸中加入FeO:FeO+2H+═Fe2++H2O | |
| B. | 向Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 向AgNO3溶液中加入过量的氨水:Ag++NH3•H2O═AgOH↓+NH4+ | |
| D. | 向热的稀硫酸中加入铜粉并鼓入空气:2Cu+4H++O2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com