
以下物品的发明与开发,属于化学对人体健康方面做出巨大贡献的是( )
A.汽车 B.青霉素
C.农药和化肥 D.电话和电视机
科目:高中化学 来源: 题型:
粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通常经过以下步骤:
①加入稍过量的BaCl2溶液;
②加入稍过量的NaOH溶液;
③加入稍过量的Na2CO3溶液;
④过滤;
⑤滴入稀盐酸至无气泡产生;
回答下列问题。
(1)实验室进行NaCl溶液蒸发时,包含以下操作步骤:①固定铁圈位置;②放上蒸发皿(蒸发皿中盛有NaCl溶液);③放置酒精灯;④加热搅拌;⑤停止加热。其正确的操作顺序为________________________。
(2)如何运用最简单方法检验粗盐的提纯步骤①后溶液中有无S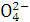 ?
?
_________________________________________________________________。
(3)步骤③加入稍过量的Na2CO3溶液,直至不再产生沉淀为止。请问这步操作的目的是 ______________________________________________________________。
(4)步骤④为过滤操作。请问这一操作能除掉哪些杂质? __________________
_________________________________________________________________。
(5)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,使用玻璃棒的作用分别是: ____________________________
__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是
A.偏铝酸钠中通足量的CO2:2AlO2— + CO2 + 3H2O = 2Al(OH)3↓ + CO32—
B.铜制印刷电路板:3Cu + 2Fe3+ == 3Cu2+ + 2Fe
C.SO2气体通入氯水中:SO2 + Cl2 + 2H2O == 4H+ + Cl—+ SO42—
D.向水玻璃中滴加盐酸:Na2SiO3 + 2 H+ == H2SiO3 ↓+ 2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
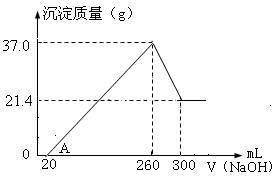
将Fe2O3 、Al2O3 两种固体混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
⑴A点坐标(20,0),0到A点的离子反应方程式为
⑵原混合物中Fe2O3的质量是 g
⑶所用NaOH溶液物质的量浓度为多少?
解题过程:
⑷稀硫酸物质的量浓度为多少?
解题过程:
查看答案和解析>>
科目:高中化学 来源: 题型:
家庭厨房实际上就是一个化学世界,柴、米、油、盐、酱、醋、糖等都属于化学物质。请回答:
(1)加碘食盐所含的碘酸钾(KIO3)中,碘元素的化合价是________价。
(2)白糖与红糖的主要成分都是蔗糖。利用活性炭的____________,可将红糖脱色变成白糖。
(3)食醋不慎滴在大理石台面上,会使其表面变得粗糙而失去光泽。这是因为食醋中的________与大理石发生了化学反应。
(4)东部城市部分家庭厨房中的“柴”将被“西气东输”工程送来的“天然气”所替代,请写出天然气主要成分的化学式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列判断正确的是( )
A.可用水来检验Na2O粉末中是否含有Na2O2
B.可用CO2来检验Na2O粉末中是否含有Na2O2
C.可利用在空气中加热的方法除去Na2O中的Na2O2
D.将足量的Na2O2、Na2O分别加到酚酞试液中,最终溶液均为红色
查看答案和解析>>
科目:高中化学 来源: 题型:
超细氮化铝粉末被广泛应用于大规模集成电路生产等领域,其制取原理为Al2O3+N2+3C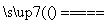 2AlN+3CO,由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质,为测定该产品中有关成分的含量,进行了以下两个实验。
2AlN+3CO,由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质,为测定该产品中有关成分的含量,进行了以下两个实验。
(1)称取10.00 g产品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成Na[Al(OH)4],并放出氨气3.36 L(标准状况)。
①上述反应的化学方程式为______________________________________________;
②计算该样品中AlN的质量分数。
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
(2)另取10.00 g样品置于反应器中,通入2.016 L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34 g·L-1(已折算成标准状况,AlN不跟O2反应)。计算该样品中含杂质炭的质量。
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com