
【题目】对下图中两极加以必要的联接并填空:
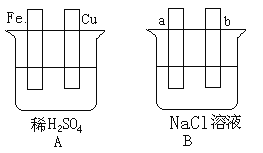
(1)在A图中,请加以必要联接,使铜片上冒H2气泡。________
Fe片的电极反应式:________________,溶液中SO42-向____(填“铁”或“铜”)片迁移。
(2)在B图中,请加以必要联接,使b极析出Cl2。总反应方程式:___________________。
(3)若将A、B串联(a接Cu,b接Fe),则a极析出的物质是____________。若导线中有0.2mol的电子通过, 则Fe片质量减少________, 同时a电极产生的气体在标准状况下的体积为__________ 。
【答案】 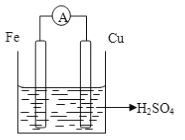
 Fe-2e-=Fe2+ 铁 2NaCl+2H2O
Fe-2e-=Fe2+ 铁 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ Cl2 5.6g 2.24L
2NaOH+H2↑+Cl2↑ Cl2 5.6g 2.24L
【解析】考查原电池的工作原理和电解原理,(1)使铜片上产生氢气,此装置可以是原电池,也可能是电解池,如果是原电池,该装置是 ,因为铁比铜活泼,且铁与硫酸反应,铜不与硫酸反应,因此铁作负极,铜作正极,负极电极反应式为Fe-2e-=Fe2+,正极电极反应式为2H++2e-=H2↑,根据原电池的工作原理,阴离子向负极移动,即SO42-向铁极移动;如果是电解池,因为铜棒上产生氢气,因此铜棒作阴极,铁棒作阳极,因此装置图是
,因为铁比铜活泼,且铁与硫酸反应,铜不与硫酸反应,因此铁作负极,铜作正极,负极电极反应式为Fe-2e-=Fe2+,正极电极反应式为2H++2e-=H2↑,根据原电池的工作原理,阴离子向负极移动,即SO42-向铁极移动;如果是电解池,因为铜棒上产生氢气,因此铜棒作阴极,铁棒作阳极,因此装置图是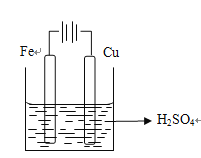 ,根据电解原理,铁是活动性金属,先放电,阳极反应式为Fe-2e-=Fe2+,阴离子向阳极移动,即移向铁极;(2)B装置是电解饱和食盐水,属于电解装置,应为b极上产生氯气,因此b极作阳极,a极作阴极,因此电解装置图为
,根据电解原理,铁是活动性金属,先放电,阳极反应式为Fe-2e-=Fe2+,阴离子向阳极移动,即移向铁极;(2)B装置是电解饱和食盐水,属于电解装置,应为b极上产生氯气,因此b极作阳极,a极作阴极,因此电解装置图为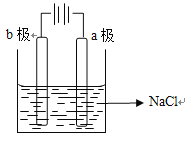 ,电解饱和食盐水,总反应方程式为2NaCl+2H2O
,电解饱和食盐水,总反应方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;(3)若将A、B串联,A为原电池,B为电解池,铜接a,a为阳极,则b为阴极,阳极反应式为2Cl--2e-=Cl2↑,析出的物质是Cl2;铁片上电极反应式为Fe-2e-=Fe2+,转移0.2mol电子,消耗铁的物质的量为0.1mol,即质量减少0.1×56g=5.6g,a极上产生氯气的体积为0.1×22.4L=2.24L。
2NaOH+H2↑+Cl2↑;(3)若将A、B串联,A为原电池,B为电解池,铜接a,a为阳极,则b为阴极,阳极反应式为2Cl--2e-=Cl2↑,析出的物质是Cl2;铁片上电极反应式为Fe-2e-=Fe2+,转移0.2mol电子,消耗铁的物质的量为0.1mol,即质量减少0.1×56g=5.6g,a极上产生氯气的体积为0.1×22.4L=2.24L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)NH4NO3的水溶液呈 ____________(填“酸”、“中”、“碱”)性,常温时的pH_________7(填“>”、“=”、“<”),原因是(用离子方程式表示)_______________________;
(2)某温度下纯水中的C(H+ )= 2×10-7mol/L,则此时溶液中的C(OH-)=_________;若温度不变,滴入稀盐酸,使C(H+ )= 5×10-4mol/L,则溶液中C(OH-)=________,此时溶液中由水电离产生的C (H+)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宋代著名法医学家宋慈的《洗冤集录》中有一“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2 =2Ag2S+2H2O。该反应中H2S是
A. 氧化剂
B. 还原剂
C. 既是氧化剂又是还原剂
D. 既不是氧化剂又不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将 2 mol SO2 和 1 mol O2 充入一定容密闭容器中,在催化剂存在下进行下列反应: 2SO2(g)+ O2(g)![]() 2SO3(g);△H= -197 kJ/ mol,下列说法中正确的是
2SO3(g);△H= -197 kJ/ mol,下列说法中正确的是
A. 达到反应限度时,生成 SO3 为2 mol
B. 达到反应限度时,反应放出 197 kJ 的热量
C. 达到反应限度时SO2、O2、SO3的分子数之比一定为2∶1∶2
D. 达到反应限度时SO2的消耗速率必定等于SO3的消耗速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用序号填写下列空格:
(1)下列各组物质
①O2和O3 ②H2、D2和T2 ③12C和14 C ④石墨和足球烯(C60)
⑤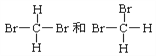 ⑥
⑥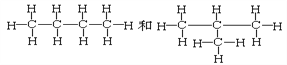
⑦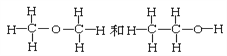 ⑧CH3CH3和CH3CH2CH2CH3
⑧CH3CH3和CH3CH2CH2CH3
互为同素异形体的是_____________;互为同位素的是______________,互为同分异构体的是______________,互为同系物的是_______________,同一种物质的是______________。
(2)现有① 金刚石 ② 干冰 ③ Na2SO4 ④ NH4Cl 四种物质,按下列要求回答:
晶体熔化时需要破坏共价键的是____________;熔点最低的是__________________;
晶体中只存在一种微粒间作用力是______________;属于离子晶体的是_____________。
请写出④ NH4Cl的电子式___________________
试判断 ①金刚石②干冰 ③Na2SO4晶体的熔点由高到低排列的顺序_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中气体作氧化剂的是( )
A.SO3通入水中:SO3+H2O=H2SO4
B.Cl2通入FeCl2溶液中:Cl2+2FeCl2=2FeCl3
C.HCl通入NaOH溶液中:HCl+NaOH=NaCl+H2O
D.CO2通入NaOH溶液中:CO2+2NaOH=Na2CO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类正确的是( )
A.氯化钡、四氯化碳、硫酸、碘酒都属于化合物
B.硝酸、纯碱、磷酸钠、二氧化碳分别属于酸、碱、盐、氧化物
C.溶液、浊液、胶体、空气都属于混合物
D.CO2、SO2、P2O5、CO都属于酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种低碳能源,在全球能源危机和环境污染的背景下具有良好的发展前景。在催化剂作用下可用H2和CO合成甲醇,反应的化学方程式为 2H2(g)+CO(g)![]() CH3OH(g),三种物质的物质的量浓度随时间变化的关系如图所示。
CH3OH(g),三种物质的物质的量浓度随时间变化的关系如图所示。

回答下列问题:
(1)代表H2浓度变化的曲线为_______(填“a”、“b”或“c”)。
(2)提出一条可以加快反应速率的措施:______________________________。
(3)04 min内,CH3OH的平均反应速率为_________________。
(4)我国某高校化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。

①该电池工作时,c口通入的物质为_____________,该电极为____(填“正极”或“负极”)。
②该电池工作一段时间后,,当6.4 g甲醇完全反应生成CO2时,消耗的氧气的体积为_____L(标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com