
醇酸树脂是一种成膜性好的树脂,下面是一种醇酸树脂的合成线路:

 |
已知:
(1)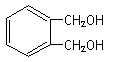
 中的含氧官能团的名称为 。
中的含氧官能团的名称为 。
(2)反应①的化学方程式是 。
(3)写出B的结构简式是 。
(4)反应①~③中属于取代反应的是 (填序号)。
(5)反应④的化学方程式为是 。
(6)反应⑤的化学方程式是 。
(7)下列说法正确的是 (填字母)。
a.B存在顺反异构
b.1 mol E与足量的银氨溶液反应能生成2 mol Ag
c.F能与NaHCO3反应产生CO2
d.丁烷、1-丙醇和D中沸点最高的为丁烷
(8)写出符合下列条件的与
 互为同分异构体的结构简式 。
互为同分异构体的结构简式 。
a.能与浓溴水反应生成白色沉淀
b.苯环上一氯代物有两种
c.能发生消去反应
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
常温条件,下列溶液的有关说法正确的是
A.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊
溶液呈红色
B.0.1 mol/L的NH4Cl溶液中:c(NH4+) = c(Cl-)
C.同为0.1 mol/L的硫酸和氨水等体积混合后:
c(NH4+) + 2c(NH3·H2O) = 2c(SO42-)
D.pH=3的盐酸和pH=11的氨水等体积混合后:c(OH-) = c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 O2+HbCO,37℃时,该反应的平衡常数K=220 。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是 ( )
O2+HbCO,37℃时,该反应的平衡常数K=220 。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是 ( )
A.把CO中毒病人放入高压氧仓中解毒,目的是:使平衡常数减小,且逆向移动
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.若吸入的CO与O2浓度之比等于0.001时,人的智力不会受损
D.CO与HbO2反应的平衡常数K=C(O2)·C(HbCO)/C(CO)·C(HbO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.铁表面镀锌,铁作阴极
B.钢管与电源正极连接,钢管可被保护
C.在入海口的钢铁闸门上装铜块可防止闸门被腐蚀
D.钢铁发生析氢腐蚀时,负极反应是Fe-3e-=Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S。
已知:CO(g)+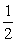 O2(g)
O2(g)  CO2(g) ∆H=-283.0 kJ/mol ①
CO2(g) ∆H=-283.0 kJ/mol ①
S(g)+ O2(g)  SO2(g) ∆H=-296.0 kJ/mol ②
SO2(g) ∆H=-296.0 kJ/mol ②
下列说法不正确的是
A.两个反应均为氧化还原反应
B.CO2与SO2可以用澄清石灰水鉴别
C.CO2分子中各原子最外层均为8电子稳定结构
D.相同条件下:2CO(g)+SO2(g)  S(g)+2CO2 (g) ∆H=-270kJ/mol
S(g)+2CO2 (g) ∆H=-270kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
另一份与氯化钡溶液完全反应消耗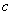 molBaCl2,则原
molBaCl2,则原 溶液中
溶液中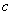 (NO
(NO )为( )
)为( )
A. mol·L-1 B.
mol·L-1 B.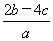 mol·1-1
mol·1-1
C.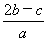 mol·L-1 D.
mol·L-1 D. mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
将30 mL 0.5 mol·L-1 NaOH溶液加水稀释到500 mL,稀释后溶液中NaOH的物质的量浓度为
A.0.3 mol·L-1 B.0.03 mol·L-1 C.0.05 mol·L-1 D.0.04 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若都做,则按A小题评分。
A.[物质结构与性质]
原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同
的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子
的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原
子序数为24。
(1)F原子基态的核外电子排布式为 ▲ 。
(2)在A、B、C三种元素中,第一电离能由大到小的顺序是 ▲ (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,其主要原因是 ▲ 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 ▲ 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 ▲ 。
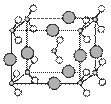 (6)由B、C、D三种元素形成的化合物晶体的晶胞如右图
(6)由B、C、D三种元素形成的化合物晶体的晶胞如右图
所示,则该化合物的化学式为 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com