
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 同一原子中,2p,3p,4p能级的轨道依次增多 | |
| B. | 当碳原子的核外电子排布由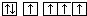 转变为 转变为 这一过程释放能量 这一过程释放能量 | |
| C. | 3p2表示3p能级有两个轨道 | |
| D. | 在同一能级上运动的电子,其运动状态可能相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯分子中含有碳碳双键 | |
| B. | 烃是指只含有碳、氢元素的有机物 | |
| C. | 燃烧后能产生C02和H20的有机物一定是烃 | |
| D. | 葡萄糖溶液中加人新制Cu(OH)2悬浊液,振荡,产生砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )| A. | 第二份溶液中最终溶质为FeSO4 | |
| B. | OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 | |
| C. | 原混合酸中NO3- 物质的量为0.1 mol | |
| D. | H2SO4 浓度为2.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
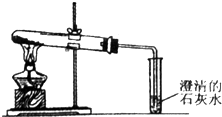
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com