
���� ��1�������������ᷴӦ�����Ȼ�����ˮ���ݴ�д����Ӧ�Ļ�ѧ����ʽ���õ��ػ�ɫ��FeCl3��Һ��
��2����FeCl3��Һ�е���NaOH��Һ�������ֽⷴӦ���к��ɫ����Fe��OH��3���ɣ�
��3�����ˮ�е��뼸�α���FeCl3��Һ�������������Һ�ʺ��ɫ�����Ƶ�Fe��OH��3���壬�������ö����ЧӦ����������������������Ⱦ۳����ɳ������������������������ᣬ�������������ܽ⣻
��4��Al��OH��3�����ܾ�ˮ���������������ɣ��к�ˮ���д��������ɳ��������ͬ��Ϊ������
��� �⣺��1��Fe2O3��ĩ������ɫ�������������ᣬ��Ӧ�����Ȼ�����ˮ����Ӧ�Ļ�ѧ����ʽΪ��Fe2O3+6HCl=2FeCl3+3H2O��FeCl3��ҺΪ�ػ�ɫ��
�ʴ�Ϊ��Fe2O3+6HCl=2FeCl3+3H2O���ػƣ�
��2����FeCl3��Һ�е���NaOH��Һ�������ֽⷴӦ��FeCl3+3NaOH�T3NaCl+Fe��OH��3�������ɺ��ɫFe��OH��3�ij�����
�ʴ�Ϊ��FeCl3+3NaOH�T3NaCl+Fe��OH��3����
��3�����ڷ��ڵ�����ˮ�м��뱥���Ȼ�����Һ������Һ��Ϊ���ɫʱ����ֹͣ���ȣ���Ӧ�Ļ�ѧ����ʽΪ��FeCl3+3H2O$\frac{\underline{\;\;��\;\;}}{\;}$Fe��OH��3�����壩+3HCl��
�ʴ�Ϊ��FeCl3+3H2O$\frac{\underline{\;\;��\;\;}}{\;}$Fe��OH��3�����壩+3HCl��
����Һ�����������ЧӦ�����������������ܲ��������ЧӦ��
�ʴ�Ϊ�����÷�ɢϵ�ܲ��������ЧӦ�����Ʊ��ɹ��������ɹ���
����Fe��OH��3��������μ��������ϡ���ᣬ�����ڵ������Һ���������������²����۳������к��ɫ�������ɣ�����������������������ֺ����ᷴӦ����ˮ�Ϳ����Ե��Ȼ�����Fe��OH��3+3HCl=FeCl3+3H2O�����ӷ�ӦΪ��Fe��OH��3+3H+=Fe3++3H2O����������Ϊ����ʼ�μ�ʱ�к��ɫ�������֣������μӳ����ܽ⣬
�ʴ�Ϊ����ʼ�μ�ʱ�к��ɫ�������֣������μӳ����ܽ⣻Fe��OH��3+3H+=Fe3++3H2O��
��4��Al��OH��3�����ܾ�ˮ���������������ɣ��к�ˮ���д��������ɳ��������ͬ��Ϊ������Fe��OH��3����Ҳ������ɣ�������ͬ�ľ�ˮЧ����
�ʴ�Ϊ���ܣ�
���� ���⿼���������������ʡ����������������ȡ����ѧ���ʣ�ע�ⶡ���ЧӦ�ǽ������е����ʣ������ڻ����������������յĿ��飬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ױ��������ڹ����·�Ӧ��Ҫ����2��4-���ȼױ� | |
| B�� | ����Ũ���ᡢŨ���Ṳ�Ȳ�����55-60�淴Ӧ���������� | |
| C�� | ����ϩ�ں��������´�����������һ������� | |
| D�� | ��ϩ��������Ȼ�̼��Һ��Ӧ����1��2-�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | A��B��C��D | B�� | C��A��D��B | C�� | A��C��D��B | D�� | B��D��C��A |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��NH3���ȶ��Ա�PH3��ǿ���ǿ������������
��NH3���ȶ��Ա�PH3��ǿ���ǿ�������������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
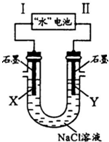 �о���Ա������һ�֡�ˮ����أ����ܷ�ӦΪ��5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl����ͼ�á�ˮ�����Ϊ��Դ���NaCl��Һ��ʵ���У�X�缫������ɫ�����ݳ��������йط�����ȷ���ǣ�������
�о���Ա������һ�֡�ˮ����أ����ܷ�ӦΪ��5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl����ͼ�á�ˮ�����Ϊ��Դ���NaCl��Һ��ʵ���У�X�缫������ɫ�����ݳ��������йط�����ȷ���ǣ�������| A�� | IΪ��������缫��ӦʽΪAg+Cl-+e-=AgCl | |
| B�� | ��ˮ�������Na+�������������ƶ� | |
| C�� | ÿת��1 mol e-��U��������0.5 mol H2O | |
| D�� | ��ˮ������ڣ�ÿ����1 mol Na2Mn5O10��X�缫������1 mol���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | ������̼ | C�� | ú | D�� | ̼�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ʵ���� | �����Լ� | ʵ������ |
| �� | 2�� 0.1mol/L��FeCl3����Һ | �ٰ�ɫ����ת��Ϊ���ɫ���� |
| �� | 4mL2mol/LNH4Cl��Һ | �ڰ�ɫ�����ܽ⣬����ɫ��Һ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com