
| A. | 已知 0.2 mol•L-1的NaHSO3溶液中pH<7,则溶液中一定有:c(H2SO3)<c(SO32-) | |
| B. | 0.02 mol/L的NaOH溶液与0.02 mol/L的NaHC2O4溶液等体积混合液:2c(OH-)+c(C2O42-)=c(HC2O4-)+2c(H+) | |
| C. | 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 叠氮酸(HN3)与醋酸酸性相近,0.1 mol•L-1NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+) |
分析 A.已知 0.2 mol•L-1的NaHSO3溶液中pH<7,溶液显酸性,HSO3-电离大于其水解程度;
B.0.02 mol/L的NaOH溶液与0.02 mol/L的NaHC2O4溶液等体积混合液生成Na2C2O4溶液,溶液中电荷守恒和物料守恒计算分析判断;
C.溶液中存在电荷守恒;
D.NaN3水溶液呈碱性,N3-水解.
解答 解:A.已知 0.2 mol•L-1的NaHSO3溶液中pH<7,溶液显酸性,HSO3-电离大于其水解程度,c(H2SO3)<c(SO32-),故A正确;
B.0.02 mol/L的NaOH溶液与0.02 mol/L的NaHC2O4溶液等体积混合液生成Na2C2O4溶液,根据物料守恒得c(Na+)=2c(HC2O4-)+2c(H2C2O4)+2c(C2O42-),根据电荷守恒得c(H+)+c(Na+)=c(HC2O4-)+2c(C2O42-)+c(OH-),所以得c(H+)+2c(H2C2O4)+c(HC2O4-)=c(OH-),故B错误;
C.向氨水中逐滴滴入盐酸至溶液的pH=7,c(H+)=c(OH-),溶液中电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-),则混合液中c(NH4+)=c(Cl-),故C正确;
D.叠氮酸(HN3)与醋酸酸性相似,醋酸钠溶液呈碱性,则NaN3水溶液呈碱性,存在c(Na+)>c(N3-)>c(OH-)>c(H+),故D正确;
故选B.
点评 本题考查离子浓度的大小比较、电荷守恒、物料守恒,题目难度中等,注意把握题给信息,此为解答该题的关键,注意亚硫酸钠溶液中亚硫酸根离子水解程度小于亚硫酸根离子电离.


科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物理量 | V(0.20mol/H2 | V(蒸馏水)/mL | V(0.010mol/L KMnO4溶液)/mL | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 50 | |
| ② | 2.0 | 0 | 4.0 | 25 | |
| ③ | 1.0 | a | 4.0 | 25 |
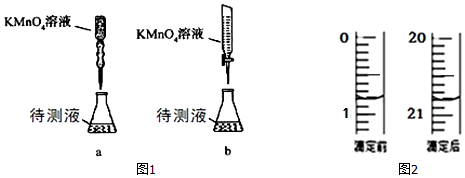
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
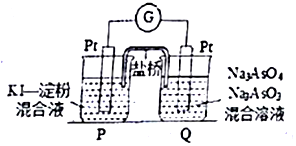 砷(As)是第四周期第VA族元素,用化学用语回答问题.
砷(As)是第四周期第VA族元素,用化学用语回答问题. ,其气态氢化物的稳定性比AsH3强(填“强”或“弱”)
,其气态氢化物的稳定性比AsH3强(填“强”或“弱”)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
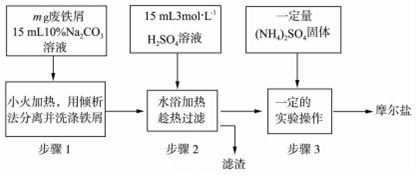
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
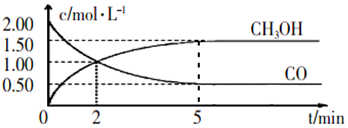
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
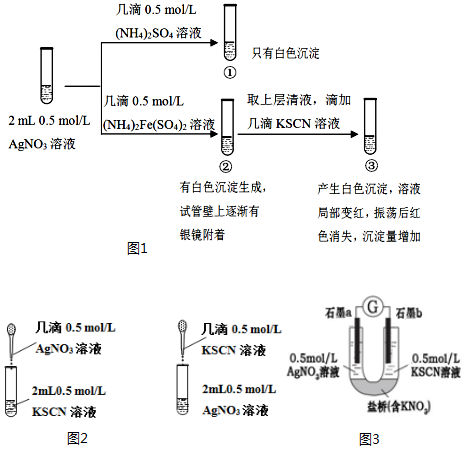
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com