
某元素的逐级电离能(kJ·mol-1)分别为740、1 500、7 700、10 500、13 600、18 000、21 700,当它与氯反应时最可能生成的阳离子是( )
A.X+ B.X2+
C.X3+ D.X4+
科目:高中化学 来源: 题型:
氢溴酸在医药和石化工业上有广泛用途。模拟工业制备氢溴酸的流程如图所示:

回答下列问题:
(1)混合①中发生反应的离子方程式为_________________________________________
________________________________________________________________________。
(2)混合②中加入试剂a是________________________。
(3)加入Na2SO3的目的是除去过量的Br2,但要防止过量,原因是____________________________(请用离子方程式表示)。
(4)工业氢溴酸常带有淡淡的黄色,可能的原因是:①含Fe3+,②含Br2,③含Fe3+和Br2,只用下列一种试剂就能分析产生淡黄色的原因。该试剂是____(填字母)。
a.KMnO4溶液 b.NaOH溶液
c.KSCN溶液 d.淀粉KI溶液
e.CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:C2H4(g)+H2O(g)===C2H5OH(g) ΔH=-45.5 kJ·mol-1。
乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。
下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中nH2O∶nC2H4=1∶1)。
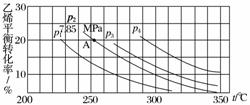
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=________________________________________________________________________
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②图中压强(p1、p2、p3、p4)的大小顺序为__________,理由是________________________________________________________________________
________________________________________________________________________。
③气相直接水合法常用的工艺条件为磷酸/硅藻土为催化剂,反应温度290 ℃、压强6.9 MPa,nH2O∶nC2H4=0.6∶1,乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有________________________、________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
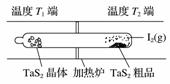
T℃时,在V L恒容密闭容器中加入足量的TaS2(s)和1 mol I2(g),发生反应TaS2(s)+2I2(g)TaI4(g)+S2(g) ΔH>0。t min时生成0.1 mol TaI4。下列说法中正确的是( )
A.0~t min内,v(I2)=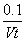 mol· L-1·min -1
mol· L-1·min -1
B.若T ℃时反应的平衡常数K=1,则平衡时I2的转化率为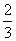
C.图中制备TaS2晶体过程中循环使用的物质是S2(g)
D.图中T1端得到纯净TaS2晶体,则温度T1>T2
查看答案和解析>>
科目:高中化学 来源: 题型:
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是
C8H10(g)C8H8(g)+H2(g) ΔH=125 kJ·mol-1
Ⅰ.某温度下,将0.40 mol苯乙烷,充入2 L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)当反应进行到20 min时,该段时间内H2的平均反应速率是________。
(2)该温度下,该反应的化学平衡常数是____________。
(3)若保持其他条件不变,用0.40 mol H2(g)和0.40 mol C8H8(g)合成C8H10(g),当有30 kJ热量放出时,该反应中H2的转化率是________________。此时,该反应是否达到了平衡状态?________(填“是”或“否”)。
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示。
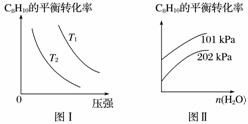
(4)由图Ⅰ可知,T1________T2(填“大于”、“小于”或“等于”)。
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将________(填“越大”、“越小”或“不变”),原因是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素A的各级电离能数据如下:
| I1 | I2 | I3 | I4 | I5 | I6 | |
| I/kJ·mol-1 | 578 | 1 817 | 2 745 | 11 578 | 14 831 | 18 378 |
则元素A的常见价态是( )
A.+1 B.+2 C.+3 D.+6
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Zn2+的4s和4p轨道可以形成sp3型杂化轨道,那么[ZnCl4]2-的空间构型为( )
A.直线形 B.平面正方形
C.正四面体形 D.正八面体形
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的两种物质:
①HI和HBr ②CF4和CH4 ③PCl3和NF3 ④N2和H2 ⑤ICl和Br2 ⑥NO和N2 ⑦正丁烷和异丁烷,它们的熔、沸点前者高于后者的是( )
A.只有①②③④ B.只有⑤⑥⑦
C.都是 D.都不是
查看答案和解析>>
科目:高中化学 来源: 题型:
随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分是CH4)为原料经合成气(主要成分为CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。请回答下列问题:
(1)[Fe(CO)5]中铁的化合价为0,写出铁原子的基态电子排布式:_________________________。
(2)与CO互为等电子体的分子和离子分别为________和________(各举一种即可,填化学式),CO分子的电子式为________,CO分子的结构式可表示成________。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有________________,CH3OH的熔、沸点比CH4高,其主要原因是_______________________________________。
(4)CH3CHO分子中,—CH3中的碳原子采取________杂化方式,—CHO中的碳原子采取________杂化方式。
★ ★★
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com