
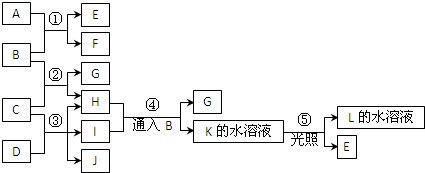


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
| A、过量氯气通入溴化亚铁溶液中:3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2 |
| B、过量二氧化碳通入偏铝酸钠溶液中:CO2+2H2O+AlO2-=Al(OH)3↓+HCO3- |
| C、亚硫酸氢铵溶液与等物质的量氢氧化钠混合:NH4++HSO3-+2OH-=SO32-+NH3↑+2H2O |
| D、碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:

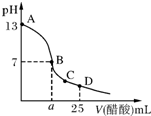
| A、在任何溶液中,c(Ca2+)、c(SO42-)均相等 |
| B、d点溶液通过蒸发可以变到c点 |
| C、a点对应的Ksp等于c点对应的Ksp |
| D、b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol金刚石晶体中含1mol碳碳单键 |
| B、标准状况下,22.4LCCl4中含C-Cl单键为4NA |
| C、1L1mol/L的CH3COOH溶液中所含的离子和分子总数为0.5NA |
| D、16.9克过氧化钡(BaO2)固体中阴、阳离子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol?L-1的NaClO溶液中所含ClO-的数目为NA | ||
B、常温常压下,1g氧气含O2分子数目为
| ||
| C、1mol Na2O2晶体中含阴、阳离子总数为4NA | ||
| D、将11.2L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知常温下HF的Ka=3.6×10-4;CH3COOH的Ka=1.8×10-5.现有①0.2mol/L KOH溶液、②0.2mol/L CH3COOH溶液、③0.2mol/L HF溶液、④0.2mol/L HCl溶液,则:
已知常温下HF的Ka=3.6×10-4;CH3COOH的Ka=1.8×10-5.现有①0.2mol/L KOH溶液、②0.2mol/L CH3COOH溶液、③0.2mol/L HF溶液、④0.2mol/L HCl溶液,则:查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下将HA和HB两种一元酸的溶液分别加水稀释,稀释时溶液pH的变化如图所示.以下叙述中不正确的是.( )
常温下将HA和HB两种一元酸的溶液分别加水稀释,稀释时溶液pH的变化如图所示.以下叙述中不正确的是.( )| A、HB是一种弱酸 |
| B、稀释前,c(HA)<10c(HB) |
| C、在NaB和HB的混合溶液中一定存在:c(B-)>c(Na+)>c(H+)>c(OH-) |
| D、在M点的两种溶液中:c(B-)=c(A-),且c(B-)+c(H+)>c(A-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com