
| A、乙烯 | B、乙醇 |
| C、甲酸甲酯 | D、乙酸 |
| m |
| M |
| 5.4g |
| 18g/mol |
| 20g |
| 100g/mol |
| 20g |
| 100g/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸和氢氧化钠溶液反应 |
| B、氢氧化镁和盐酸反应 |
| C、澄清石灰水和硝酸反应 |
| D、氢氧化钡和稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


| 化学式 | CaCO3 | CaSO4 | Ca(OH)2 | MgCO3 | Mg(OH)2 |
| Ksp | 2.8×10-9 | 9.1×10-6 | 1.0×10-4 | 3.5×10-5 | 1.6×10-11 |
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | ||
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
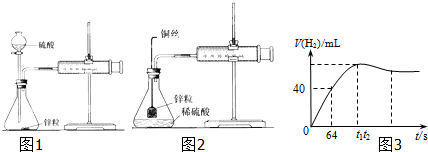
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 实验步骤 | 预期现象与结论 |
| 步骤I:取少量样品于一支试管中,向其中加入适量 ,塞上带导管的单孔塞,将导管另一端插入盛有足量 的试管中 | |
| 步骤II: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐溶液都是中性的 |
| B、盐溶液的酸碱性与盐的类型无关 |
| C、NaHCO3溶液显酸性 |
| D、碳酸钠溶液显碱性,溶液中c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com