
【题目】已知A为金属单质,下列物质相互转化如图所示:

试回答:
(1)写出B的化学式________,D的化学式_________。
(2)写出由E转变成F的化学方程式____________________________________。
(3)检验G溶液中阳离子的试剂为__,写出发生反应的离子方程式____________。
(4)某同学取B的溶液酸化后加入碘化钾淀粉溶液,在空气中放置一会儿变为蓝色,写出与上述变化过程相关的离子方程式__________________,____________。
【答案】FeCl2 KCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 KSCN Fe3++3SCN=Fe(SCN)3 4Fe2++O2+4H+=4Fe3++2H2O 2Fe3++2I=2Fe2++I2
【解析】
白色沉淀E在空气中变化为红褐色沉淀F,说明E为Fe(OH)2,F为Fe(OH)3,F与盐酸反应生成G为FeCl3,金属A与氯化铁反应生成B,B与C反应得到E与D,故A为Fe,B为FeCl2,则Fe与盐酸反应生成氢气与FeCl2;D溶液和硝酸酸化的硝酸银反应生成白色沉淀H为AgCl,溶液透过钴玻璃进行焰色反应为紫色,证明溶液中含有钾元素,故D为KCl,则C为KOH,据此进行解答。
(1)根据以上分析,A是Fe;B的化学式为FeCl2,D的化学式为KCl;
(2)由E转变成F是氢氧化亚铁被氧化为氢氧化铁,反应的化学方程式为:4 Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)G为FeCl3溶液,可用KSCN溶液鉴别G溶液中Fe3+离子,反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3;
(4)B为FeCl2溶液,取B的溶液酸化后加入碘化钾淀粉溶液,在空气中放置一会儿变为蓝色,是由于发生反应:4Fe2++4H++O2=4Fe3++2H2O,2Fe3++2I-=2Fe2++I2,碘单质遇淀粉溶液变为蓝色。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组设计了下列装置,验证二氧化碳跟过氧化钠反应时需要与水接触。
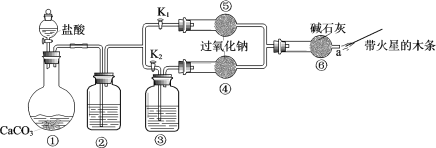
(装置分析)
(1)装置①中反应的离子方程式是______。
(2)装置②中的试剂是______(填序号)。
a.饱和NaHCO3溶液 b.饱和Na2CO3溶液 c.浓H2SO4
(3)装置③中的试剂是______。
(进行实验)
步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条
放在a处。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条
放在a处。
(1)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是______。
(2)过氧化钠跟二氧化碳反应的化学方程式是______。
(实验反思)
(1)有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应。”其理由是______。
(2)需要补充的实验操作是:取⑤中反应后的少量固体,______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,一定温度下发生反应2N2O5(g)4NO2(g)+O2(g) ΔH>0, T1温度下的部分实验数据如下表所示。
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/(mol/L) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A. 该反应在任何温度下均能自发进行
B. T1温度下的平衡常数为K1=125,1 000 s时N2O5(g)转化率为50%
C. 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。
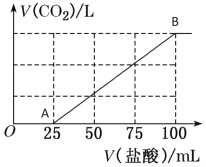
(1)A-B段的离子反应方程式为__________________________。
(2)原NaOH溶液的浓度为__________mol/L。
(3)通入CO2在标准状况下的体积为_______mL。
(4)所得溶液的溶质成分是_______________,其物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 甲苯既可使溴的CCl4溶液褪色,也可使KMnO4酸性溶液褪色
B. 有机物![]() 的消去产物有2种
的消去产物有2种
C. 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2===CH—COOCH3
D. 可用溴水鉴别直馏汽油、四氯化碳和乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢H2O2(氧的化合价为﹣1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2+H2O
C.2H2O2===2H2O+O2
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是_________(填代号)。
(2)H2O2既体现氧化性又体现还原性的反应是_________(填代号)。
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2﹣2e﹣===2H++O2↑
还原反应:MnO![]() +5e﹣+8H+===Mn2++4H2O
+5e﹣+8H+===Mn2++4H2O
写出该氧化还原反应的离子方程式:___________________。
(4)在K2Cr2O7+14HCl===2KCl+3Cl2↑+7H2O+2CrCl3的反应中,有0.3 mol电子转移时生成Cl2的体积为______(标准状况),被氧化的HCl的物质的量为____。
(5)除去镁粉中混入的铝粉杂质用溶解、_______方法,化学反应方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是一种多功能、高效无毒的新型绿色水处理剂。
(1)Na2FeO4中铁元素的化合价是______价,Na2FeO4能给水消毒利用的是________性。
(2)用Na2FeO4给水消毒、杀菌时得到的Fe3+可以净水,Fe3+净水原理是______________(用简要的文字叙述)。
(3)工业上可用FeCl3、NaOH 、NaClO三种物质在一定条件下反应制得Na2FeO4,配平反应的离子方程式:_____Fe3+ +_____OH-+____ClO- =_____FeO42-+ _____![]() + ______Cl- ,____________氧化剂为________,若反应过程中转移了0.5 mol电子,则还原产物的物质的量为________ mol。
+ ______Cl- ,____________氧化剂为________,若反应过程中转移了0.5 mol电子,则还原产物的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在科研和生产中有广泛应用。
(1)用生物质热解气(主要成分为CO、CH4、H2)将SO2在一定条件下还原为单质硫进行烟气脱硫。已知:
①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g) △H2= + 172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g) △H3=- 296.0 kJ·mol-1
CO将SO2还原为单质硫的热化学方程式为________________________。
(2)CO可用于合成甲醇,一定温度下,向体积为2 L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),5分钟后达到平衡测得各组分物质的量如下:
CH3OH(g),5分钟后达到平衡测得各组分物质的量如下:
物质 | CO | H2 | CH3OH |
物质的量(mol) | 1.8 | 2.0 | 1.2 |
①反应达到平衡时,CO的转化率为_______,5分钟内用H2表示的速率为________
②该反应的平衡常数K=__________。
③恒温恒容条件下,可以说明反应已达到平衡状态的是__________(填标号)。
A.v正(CO)=2v逆(H2) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.CO、H2的浓度之比为1:2
E.单位时间内,每生成1mol H2消耗2mol CH3OH
④若将容器体积压缩到1L,则达到新平衡时c(H2)的取值范围是_____________。
⑤若保持容器体积不变,再充入0.6 mol CO 和0.4 mol CH3OH,此时v正 __________v逆(填“ >” < ”或“= ”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com