
| A. | C2H6 | B. | C2H6O | C. | C2H6O2 | D. | C3H6O3 |
分析 浓硫酸增重10.8g为反应生成的水的质量,通过灼热氧化铜,发生反应:CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,利用差量法可计算CO的物质的量,碱石灰的质量增加17.6g为总CO2的质量,减去CO与CuO反应生成的CO2的质量为有机物燃烧生成CO2的质量,根据原子守恒计算有机物中含有C、H、O原子数目,进而确定有机物化学式.
解答 解:有机物燃烧生成水10.8g,物质的量为$\frac{10.8g}{18g/mol}$=0.6mol,
令有机物燃烧生成的CO为x,则:
CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 固体减少△m
28g 16g
x 3.2g
所以x=$\frac{28g×3.2g}{16g}$=5.6g,CO的物质的量为$\frac{5.6g}{28g/mol}$=0.2mol,
根据碳元素守恒可知CO与CuO反应生成的CO2的物质的量为0.2mol,质量为0.2mol×44g/mol=8.8g.
有机物燃烧生成的CO2的质量为17.6g-8.8g=8.8g,物质的量为$\frac{8.8g}{44g/mol}$=0.2mol,
根据碳元素守恒,有机物分子中N(C)=$\frac{0.2mol+0.2mol}{0.2mol}$=2,
根据氢元素守恒,有机物分子中N(H)=$\frac{0.6mol×2}{0.2mol}$=6,
根据氧元素守恒,有机物分子中N(O)=$\frac{0.6mol+0.2mol+0.2mol×2-0.4mol×2}{0.2mol}$=2,
所以有机物的分子式为C2H6O2,
故选:C.
点评 本题考查有机物分子式确定,属于计算型推断,注意利用原子守恒判断有机物的分子式,难度中等.


科目:高中化学 来源: 题型:解答题
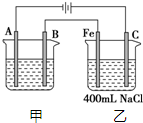 如图所示为相互串联的甲、乙两电解池.试回答:
如图所示为相互串联的甲、乙两电解池.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I-,Fe2+,Cl-,Mn2+ | B. | Cl-,Mn2+,I-,Fe2+ | ||
| C. | Mn2+,Cl-,I-,Fe2+ | D. | MnO4-,Cl2,Fe3+,I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑦ | B. | ①②④⑤ | C. | ②③④⑤ | D. | ①②⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Pb(NO3)2是反应物;HNO3是生成物 | B. | HMnO4是反应物;MnSO4是生成物 | ||
| C. | HNO3是反应物;H2O是生成物 | D. | H2O是反应物;HMnO4是生成物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2时CH3COOH溶液 | B. | 0.01mol/L Na2SO3溶液 | ||
| C. | 0.001mol/L盐酸 | D. | pH=10氨水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com