
| A. | 需要用托盘天平称量NaOH固体的质量为1.92g | |
| B. | 将NaOH固体在小烧杯中加水溶解后立即倒入容量瓶中并进行定容 | |
| C. | 在容量瓶中定容时俯视容量瓶刻度线会使溶液浓度偏高 | |
| D. | 定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线 |
分析 需要配制0.1mol/LNaOH溶液480mL,实验室没有480mL容量瓶,应选择500mL容量瓶,实际配制500mL溶液,依据m=CVM计算需要溶质的质量,结合容量瓶使用方法及依据C=$\frac{n}{V}$进行误差分析,即可解答.
解答 解:A.需要配制0.1mol/LNaOH溶液480mL,实验室没有480mL容量瓶,应选择500mL容量瓶,需要氢氧化钠的质量m=0.1mol/L×40g/mol×0.5L=2.0g,故A错误;
B.容量瓶为精密仪器,不能用来盛放过热液体,氢氧化钠溶解释放大量的热,应冷却到室温再进行移液操作,故B错误;
C.在容量瓶中定容时俯视容量瓶刻度线,导致溶液体积偏小,依据C=$\frac{n}{V}$可知溶液浓度偏高,故C正确;
D.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,导致溶液体积偏大,依据C=nV可知溶液浓度偏低,故D错误;
故选:C.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理是解题关键,注意容量瓶规格的选择及容量瓶使用注意事项,题目难度不大.


科目:高中化学 来源: 题型:解答题
 ;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH2CH2CH3+H2O.
;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH2CH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SO3、CO2均为酸性氧化物 | |
| B. | 稀豆浆、氯化铁溶液均为胶体 | |
| C. | 烧碱、冰醋酸、四氯化碳、氨气均为电解质 | |
| D. | 氨水、漂白粉、氢氟酸、小苏打均为纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B和D、C和D组成的常见化合物中化学键的类型相同 | |
| B. | 同周期元素中D的最高价氧化物对应水化物的酸性最强 | |
| C. | 氢化物的热稳定性:HnB<HnD | |
| D. | 离子半径的大小顺序:rD>rB>rC>rA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
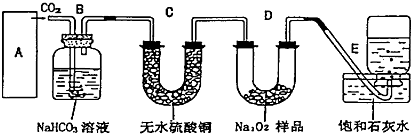

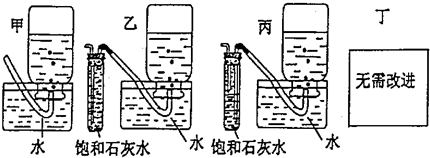
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
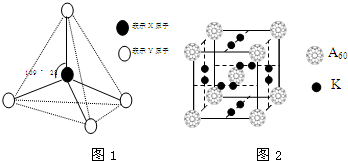 现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图1所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.工业上利用单质A的同素异形体能与B物质发生置换反应,制取单质G的粗产品.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.
现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图1所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.工业上利用单质A的同素异形体能与B物质发生置换反应,制取单质G的粗产品.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.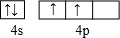 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com