
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是
(用必要的化学用语和相关文字说明).
(2)相同条件下,0.1mol•L﹣1 NH4Al(SO4)2中c(NH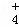 ) (填“等于”“大于”或“小于”)0.1mol•L﹣1 NH4HSO4中c(NH
) (填“等于”“大于”或“小于”)0.1mol•L﹣1 NH4HSO4中c(NH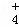 ).
).
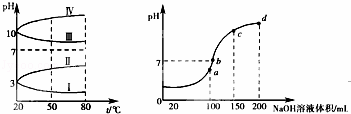
(3)如图1所示是0.1mol•L﹣1电解质溶液的pH随温度变化的图象.
①其中符合0.1mol•L﹣1 NH4Al(SO4)2的pH随温度变化的曲线是 (填写序号),导致pH随温度变化的原因是 ;
②20℃时,0.1mol•L﹣1 NH4Al(SO4)2中2c(SO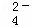 )﹣c(NH
)﹣c(NH )﹣3c(Al3+)= (填数值).
)﹣3c(Al3+)= (填数值).
(4)室温时,向100mL 0.1mol•L﹣1 NH4HSO4溶液中滴加0.1mol•L﹣1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图2所示:试分析图中a、b、c、d四个点,水的电离程度最大是 点;在b点,溶液中各离子浓度由大到小的排列顺序是 .
考点:
常见的食品添加剂的组成、性质和作用;反应热和焓变;离子浓度大小的比较;酸碱混合时的定性判断及有关ph的计算.
专题:
基本概念与基本理论.
分析:
(1)Al3+水解生成的Al(OH)3具有吸附性;
(2)NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4﹣电离出H+同样抑制NH4+水解;
(3)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大;
②根据电荷守恒定律解题;
(4)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性.
解答:
解:(1)Al3+水解生成的Al(OH)3具有吸附性,离子方程式:Al3++3H2O═Al(OH)3+3H+,Al(OH)3,
故答案为:Al3+水解生成的Al(OH)3具有吸附性,即Al3++3H2O═Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水;
(2)NH4Al(SO4)2与NH4HSO4中的NH4+均发生水解,但是NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4﹣电离出H+同样抑制NH4+水解,因为HSO4﹣电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4中NH4+水解程度比NH4Al(SO4)2中的小,故答案为:小于;
(3)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为Ⅰ,
故答案为:1;NH4Al(SO4)2水解,溶液呈酸性,升高温度,其水解程度增大,pH减小;
②根据电荷守恒,可以求出2c(SO42﹣)﹣c(NH4+)﹣3c(Al3+)=c(H+)﹣c(OH﹣)=10﹣3 mol•L﹣1,故答案为:10﹣3 mol•L﹣1;
(4)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,a点时c(Na+)=c(SO42﹣),b点时c(Na+)>c(SO42﹣),根据N元素与S元素的关系,可以得出c(SO42﹣)>c(NH4+),故c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+),
故答案为:a;c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+).
点评:
本题考查盐类的水解和离子浓度大小的比较,题目难度较大,(3)②为易错点,注意根据守恒思想解题.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
某小组用如图装置进行实验,下列说法正确的是
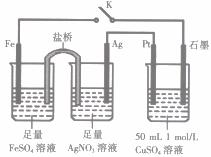
A.盐桥中的电解质可以用KC1
B.闭合K,外电路电流方向为Fe电极→石墨电极
C.闭合K,石墨电极上只生成铜
D.导线中流过0.15 mol e-时,加入5.55 gCu2(OH)2CO3 ,CuSO4溶液可恢复原组成
查看答案和解析>>
科目:高中化学 来源: 题型:
由乙烯推测丙烯(CH2═CH﹣CH3)的结构或性质不正确的是( )
|
| A. | 能使酸性高锰酸钾溶液褪色 |
|
| B. | 能在空气中燃烧 |
|
| C. | 能使溴水褪色 |
|
| D. | 与HCl在一定条件下能加成只得到一种产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
温时,M(OH)2(s)⇌M2+(aq)+2OH﹣(aq)Ksp=a,c(M2+)=b mol•L﹣1时,溶液的pH等于( )
|
| A. |
| B. |
| C. | 14+ | D. | 14+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学研究的正确说法是( )
|
| A. | 同时改变两个变量来研究反映速率的变化,能更快得出有关规律 |
|
| B. | 对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 |
|
| C. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 |
|
| D. | 从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属递增的规律 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于外界条件的改变对化学反应速率影响的说法中正确的是( )
|
| A. | 升高温度能加快吸热反应速率,减慢放热反应速率 |
|
| B. | 增大压强能加快气体体积缩小方向的反应速率,减慢气体体积增大方向的反应速率 |
|
| C. | 压强的改变只有通过浓度的改变才能影响化学反应速率 |
|
| D. | 若外界条件的改变引起了正、逆反应速率的改变,就一定能引起化学平衡的移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质分类正确的是( )
碱性氧化物 酸性氧化物 酸 碱 盐
A MgO Mn2O7 H3PO4 Ca(OH)2 KAl(SO4)2•12H2O
B Na2O NO2 HNO3 CH3OH NaCl
C Al2O3 SO3 HClO NaOH AgCl
D CaO SiO2 H2S Na2CO3 CH3COONa
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣、HCO3﹣等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是( )
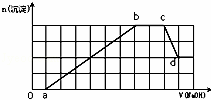
A. d点溶液中含有的溶质只有Na2SO4
B. 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
C. ab段发生的离子反应为:Al3++3OH﹣=Al(OH)3↓,Mg2++2OH﹣=Mg(OH)2↓
D. 原溶液中含有的阳离子必定有H+、NH4+、Al3+,但不能肯定Mg2+和Fe3+中的哪一种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com