
在密闭容器中加入等浓度的CO与H2O,T ℃时发生如下反应:
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH< 0
CO2(g)+H2(g) ΔH< 0
已知CO的浓度变化如图所示,第4 minCO的浓度不再改变。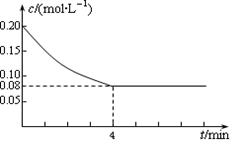
(1)从0~4 min,该反应的平均速率v(CO)= mol/(L·min);该反应的平衡常数表达式为:K= ;可计算得该反应的平衡常数结果为:K= 。
(2)为了增大CO的转化率,可以采取的措施有 。
| A.增大反应物中CO的浓度 |
| B.降低反应温度 |
| C.将密闭容器体积压缩至一半 |
| D.加入适宜的催化剂 |
(1)0.03  2.25 (2)B (3)0.90
2.25 (2)B (3)0.90
解析试题分析:(1)从0~4 min,v(CO)=(0.20mol·L-1-0.08 mol·L-1)÷4 min="0.03" mol/(L·min);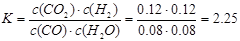 (2)增大反应物中CO的浓度,增大了H2O的转化率,但CO本身的转化率降低;降低反应温度,平衡右移,CO的转化率增大;将密闭容器体积压缩至一半,增大压强,平衡不移动,CO的转化率不变;加入适宜的催化剂,反应速率加快,平衡不移动,CO的转化率不变。(3)设水蒸气的起始浓度至少为x mol/L。当CO的转化率达到90%,则CO的转化浓度为0.18 mol/L,平衡时,CO(g)、H2O(g) 、CO2(g)和H2(g)的浓度分别为0.02 mol/L、(x-0.18)mol/L、0.18 mol/L、0.18 mol/L,代入平衡常数
(2)增大反应物中CO的浓度,增大了H2O的转化率,但CO本身的转化率降低;降低反应温度,平衡右移,CO的转化率增大;将密闭容器体积压缩至一半,增大压强,平衡不移动,CO的转化率不变;加入适宜的催化剂,反应速率加快,平衡不移动,CO的转化率不变。(3)设水蒸气的起始浓度至少为x mol/L。当CO的转化率达到90%,则CO的转化浓度为0.18 mol/L,平衡时,CO(g)、H2O(g) 、CO2(g)和H2(g)的浓度分别为0.02 mol/L、(x-0.18)mol/L、0.18 mol/L、0.18 mol/L,代入平衡常数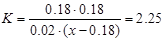 ,可求出x=0.90。
,可求出x=0.90。
考点:化学反应速率及化学平衡常数
点评:化学反应速率和化学平衡常数是高考必考知识点,考生在备考过程中应注意积累掌握典型的题型。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)①铅位于元素周期表中第_________周期第_________族;
②PbO2是一种两性氧化物,试写出PbO2和NaOH浓溶液反应的离子方程式:________________________________;
③铅蓄电池是目前最普及的一种蓄电池。它是以Pb、PbO2为电极,以H2SO4溶液为电解液。由于硫酸浓度较大,实际参加反应的是![]() ,而不是
,而不是![]() 。铅蓄电池放电时负极反应和电池总反应分别为:
。铅蓄电池放电时负极反应和电池总反应分别为:
反极反应式
Pb+![]() -2e-====PbSO4+H+
-2e-====PbSO4+H+
电池总反应式
Pb+PbO2+2H2SO4====2PbSO4+2H2O
则铅蓄电池放电时正极反应式为:____________________________________________。
(2)在真空密闭容器中加入一定量的PH4I固体,在一定温度下发生反应:
PH4I(s)![]() PH3(g)+HI(g),4PH3(g)
PH3(g)+HI(g),4PH3(g) ![]() P4(g)+6H2(g),2HI(g)
P4(g)+6H2(g),2HI(g) ![]() H2(g)+I2(g)平衡后,增大压强,溶器内n(PH4I)____________(填“增加”“减少”或“不变”,下同),n(I2) ____________。
H2(g)+I2(g)平衡后,增大压强,溶器内n(PH4I)____________(填“增加”“减少”或“不变”,下同),n(I2) ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(21分)(1)用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/LH2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃ (t2>t1),混合后溶液的比热容为c = 4.18J/(g·℃),溶液的密度都近似为1g/mL,中和热△H=__________(填表达式,不用化简);若将H2SO4溶液换成相同物质的量浓度的CH3COOH溶液,测得的△H______填(“偏大”、“偏小”或“相同”);若将稀硫酸换成浓硫酸来做该实验,测得的△H_______(填“偏大”、“偏小”或“相同”)。
(2)某高能化学物质N2H2内,氮元素的杂化类型为____,电子式为____,一个分子中有σ键 个 ,π 键 个。
(3).在密闭容器中进行可逆反应: CO(g)+NO2(g)CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
①增大容器的体积,平衡 移动(填“正向”“逆向”“不”),反应混合物的颜色 。(填“变深”“变浅”“不变”)
②容器体积不变:若通人CO2气体,平衡 移动,反应混合物的颜色 。若通人N2气体,平衡 移动,反应混合物的颜色 。③加入催化剂,平衡 移动。
(4)下表是几种常用燃料(1 mol)完全燃烧时放出的热量:
| 物质 | 炭粉(C) | 一氧化碳(CO) | 氢气(H2) | 甲烷(CH4) | 乙醇(C2H5OH) |
| 状态 | 固体 | 气体 | 气体 | 气体 | 液体 |
| 热量(kJ) | 392.8 | 282.6 | 285.8 | 890.3 | 1 367 |
①从热量角度分析,目前最适合家庭使用的优质气体燃料是________。
②写出管道煤气中的一氧化碳燃烧热的热化学方程式_______________________
③充分燃烧1mol表中各种燃料,排放出二氧化碳的量最多的是________。
④矿物燃料储量有限,而且在燃烧过程中会产生污染。根据能源多样化的发展战略,我国开发利用的绿色能源有________等。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年成都铁中高二3月检测化学试卷 题型:填空题
(21分)(1)用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/L H2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃(t2>t1),混合后溶液的比热容为c = 4.18J/(g·℃),溶液的密度都近似为1g/mL,中和热△H=__________(填表达式,不用化简);若将H2SO4溶液换成相同物质的量浓度的CH3COOH溶液,测得的△H______填(“偏大”、“偏小”或“相同”);若将稀硫酸换成浓硫酸来做该实验,测得的△H_______(填“偏大”、“偏小”或“相同”)。
(2)某高能化学物质N2H2内,氮元素的杂化类型为____,电子式为____,一个分子中有σ键 个 ,π 键 个。
(3).在密闭容器中进行可逆反应: CO(g)+NO2(g) CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
①增大容器的体积,平衡 移动(填“正向”“逆向”“不”),反应混合物的颜色 。(填“变深”“变浅”“不变”)
②容器体积不变:若通人CO2气体,平衡 移动,反应混合物的颜色 。若通人N2气体,平衡 移动,反应混合物的颜色 。③加入催化剂,平衡 移动。
(4)下表是几种常用燃料(1 mol)完全燃烧时放出的热量:
| 物质 | 炭粉(C) | 一氧化碳(CO) | 氢气(H2) | 甲烷(CH4) | 乙醇(C2H5OH) |
| 状态 | 固体 | 气体 | 气体 | 气体 | 液体 |
| 热量(kJ) | 392.8 | 282.6 | 285.8 | 890.3 | 1 367 |
查看答案和解析>>
科目:高中化学 来源:2013届成都铁中高二3月检测化学试卷 题型:填空题
(21分)(1)用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/L H2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃ (t2>t1),混合后溶液的比热容为c = 4.18J/(g·℃),溶液的密度都近似为1g/mL,中和热△H=__________(填表达式,不用化简);若将H2SO4溶液换成相同物质的量浓度的CH3COOH溶液,测得的△H______填(“偏大”、“偏小”或“相同”);若将稀硫酸换成浓硫酸来做该实验,测得的△H_______(填“偏大”、“偏小”或“相同”)。
(2)某高能化学物质N2H2内,氮元素的杂化类型为____,电子式为____,一个分子中有σ键 个 ,π 键 个。
(3).在密闭容器中进行可逆反应: CO(g)+NO2(g) CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:

①增大容器的体积,平衡 移动(填“正向”“逆向”“不”),反应混合物的颜色 。(填“变深”“变浅”“不变”)
②容器体积不变:若通人CO2气体,平衡 移动,反应混合物的颜色 。若通人N2气体,平衡 移动,反应混合物的颜色 。③加入催化剂,平衡 移动。
(4)下表是几种常用燃料(1 mol)完全燃烧时放出的热量:
|
物质 |
炭粉(C) |
一氧化碳(CO) |
氢气(H2) |
甲烷(CH4) |
乙醇(C2H5OH) |
|
状态 |
固体 |
气体 |
气体 |
气体 |
液体 |
|
热量(kJ) |
392.8 |
282.6 |
285.8 |
890.3 |
1 367 |
①从热量角度分析,目前最适合家庭使用的优质气体燃料是________。
②写出管道煤气中的一氧化碳燃烧热的热化学方程式_______________________
③充分燃烧1 mol表中各种燃料,排放出二氧化碳的量最多的是________。
④矿物燃料储量有限,而且在燃烧过程中会产生污染。根据能源多样化的发展战略,我国开发利用的绿色能源有________等。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com