Ⅰ.回答下列问题:
(1)欲量取20.00mL Na
2CO
3溶液,应选用的仪器是
碱式滴定管
碱式滴定管
.
(2)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、
环形玻璃搅拌棒
环形玻璃搅拌棒
、
量筒
量筒
.
(3)在测定硫酸铜晶体中含量的实验中,称量操作至少要进行
4
4
次.
Ⅱ.氢氧化铜是一种常用试剂.例如,利用新制氢氧化铜验证醛类物质的还原性.
(1)新制氢氧化铜悬浊液的配制,实验室制取氢氧化铜悬浊液的操作方法:在试管里加入10%的氢氧化钠溶液2mL,滴入2%的硫酸铜溶液4~6滴,振荡即成.这样操作的目的是
确保氢氧化钠过量,氢氧化铜呈悬浊状
确保氢氧化钠过量,氢氧化铜呈悬浊状
.
下面是三个研究性学习小组分别从不同层面开展的研究性学习活动:
(2)研究性学习小组甲:对教材实验结论“乙醛与新制氢氧化铜反应生成的红色沉淀是Cu
2O”提出质疑,他们认为红色沉淀不一定是氧化亚铜.为了确定红色沉淀的成分,开展了如下研究:提出猜想:
红色沉淀可能是铜或铜与氧化亚铜的混合物(或红色固体中可能含有铜)
红色沉淀可能是铜或铜与氧化亚铜的混合物(或红色固体中可能含有铜)
.
查阅资料:①氧化亚铜属于碱性氧化物;②+1价的铜离子在酸性条件下易发生自身氧化还原反应:③在空气中灼烧氧化亚铜生成氧化铜.
设计方案:方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣
方案3:称取红色沉淀ag,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次至到固体恒重,称得质量为bg,比较a,b关系
方案4:取红色固体沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色银析出.
你认为合理的方案是
方案3
方案3
.
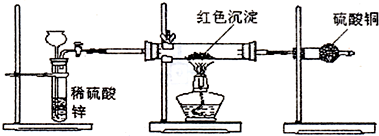
(3)研究性学习小组乙针对小组甲的质疑,设计新的探究方案,装置如图所示.你认为要测定上述红色沉淀成分必须测定下列哪些物理量(只填序号):
②③⑤
②③⑤
.
①通入氢气体积;②反应前,红色沉淀+硬质玻璃管的总质量;③完全反应后红色固体+硬质玻璃管的总质量;④实验前,干燥管质量;⑤硬质玻璃管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管质量
(4)研究性学习小组丙上网查阅新闻得知,“2005年诺贝尔化学奖授予了三位研究绿色化学的科学家”.绿色化学强调对环境友好,实现零排放.“变废为宝”符合绿色化学要求.他们收集上述红色沉淀制备化学试剂-蓝矾.请你帮助他们设计一个简单且符合绿色化学要求的实验方案:
在空气中充分灼烧该红色固体至全部转化成氧化铜,加入足量稀硫酸溶解,蒸发、结晶、过滤、洗涤,用滤纸吸干或通入惰气带走水分
在空气中充分灼烧该红色固体至全部转化成氧化铜,加入足量稀硫酸溶解,蒸发、结晶、过滤、洗涤,用滤纸吸干或通入惰气带走水分
.

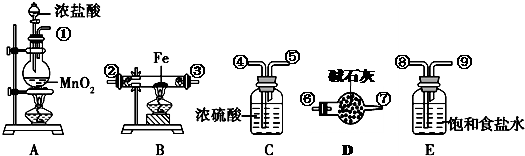
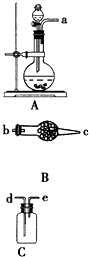 下列为实验室制取、干燥和收集氨气的装置.
下列为实验室制取、干燥和收集氨气的装置.


 高锰酸钾是深紫色的针状晶体,是最常用的氧化剂之一,工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾.下面是实验室制取高锰酸钾的过程:
高锰酸钾是深紫色的针状晶体,是最常用的氧化剂之一,工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾.下面是实验室制取高锰酸钾的过程: