
(8分)实验室可用NH4HCO3和NaCl为原料制备纯碱。请根据下表数据和实验步骤,回答下列问题: 30℃时几种盐的溶解度/g
|
NaCl |
NH4HCO3 |
NaHCO3 |
NH4Cl |
Na2SO4 |
(NH4)2SO4 |
CaCl2 |
MgCl2 |
CaSO4 |
|
36.3 |
27.0 |
11.1 |
41.4 |
40.8 |
78 |
51.7 |
26.2 |
0.165 |
制备纯碱的步骤如下:
① 配制50 mL约25%的粗食盐水溶液(密度近似为1 g/mL)。
② 精制食盐水(粗食盐中含有少量Ca2+、Mg2+、SO42-等杂质),用盐酸将滤液的pH值调至7。
③ 加热食盐水,将溶液温度控制在30 ─ 35℃。
④ 在不断搅拌下,分次将研细的NH4HCO3加入食盐水中,加完料后,继续保温、 搅拌半小时。
⑤ 静置,趁热过滤,回收母液。晶体用蒸馏水洗涤两次。
⑥ 将晶体灼烧,得到纯碱。
(1)步骤①中,配制溶液的最后一步操作是 ;
(2)步骤②中,SO42-是否需要加入某种试剂除去? ,理由是
(3)步骤④中所有操作的共同目的是 ;
(4)步骤⑤中晶体的洗涤液中主要含有的杂质阳离子是 ,在通常情况下,检验这种阳离子的实验操作为 。
(1)用玻璃棒搅拌(1分)
(2)不需要(1分);除去Ca2+、Mg2+后, 在溶液所控制的温度下,可能存在的硫酸盐的溶解度比NaHCO3大,且SO42-含量少,过滤后会留在母液中(2分)
(3)使生成NaHCO3的反应充分进行(1分)
(4)NH4+(1分);取少量待检物放入试管里,加入NaOH溶液,加热,将润湿的红色石蕊试纸放在管口,观察试纸是否变蓝(2分)
【解析】(1)由于是配制50 mL约25%的粗食盐水溶液,所以不需要容量瓶,因此最后一步是用玻璃棒搅拌溶液。
(2)由于除去Ca2+、Mg2+后, 在溶液所控制的温度下,可能存在的硫酸盐的溶解度比NaHCO3大,且SO42-含量少,过滤后会留在母液中,所以不需要除去SO42-。
(3)步骤④的目的是制取碳酸氢钠的,所以步骤④中所有操作的共同目的是使生成NaHCO3的反应充分进行。
(4)溶液中的阳离子除了钠离子外,还主要含有NH4+,所以洗涤液中主要含有的杂质阳离子是NH4+。检验方法是取少量待检物放入试管里,加入NaOH溶液,加热,将润湿的红色石蕊试纸放在管口,观察试纸是否变蓝。


科目:高中化学 来源:读想用 高二化学(上) 题型:022
| |||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:山东省青州一中2012届高三化学一轮跟踪训练:第10章第2讲物质的分离和提纯(鲁科版) 鲁科版 题型:058
实验室可用NH4HCO3和NaCl为原料制备纯碱.请根据下表数据和实验步骤,回答下列问题:
制备纯碱的步骤如下:
①配制50 mL约25%的粗食盐水溶液(密度近似为1 g/cm3).
②精制食盐水(粗食盐中含有少量Ca2+、Mg2+、SO![]() 等杂质)用盐酸将滤液的pH值调至7.
等杂质)用盐酸将滤液的pH值调至7.
③加热食盐水,将溶液温度控制在30℃~35℃.
④在不断搅拌下,分次将研细的NH4HCO3加入食盐水中,加完料后,继续保温、搅拌半小时.
⑤静置,趁热过滤,回收母液.晶体用蒸馏水洗涤两次.
⑥将晶体灼烧,得到纯碱.
(1)步骤①中,配制溶液的最后一步操作是________;
(2)步骤②中,SO![]() 是否需要除去?________,理由是________.
是否需要除去?________,理由是________.
(3)步骤④中所有操作的共同目的是________;
(4)步骤⑤中晶体的洗涤液中主要含有的杂质阳离子是________.
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省宁波四中高二下学期期末考试化学试卷(带解析) 题型:实验题
(8分)实验室可用NH4HCO3和NaCl为原料制备纯碱。请根据下表数据和实验步骤,回答下列问题: 30℃时几种盐的溶解度/g
| NaCl | NH4HCO3 | NaHCO3 | NH4Cl | Na2SO4 | (NH4)2SO4 | CaCl2 | MgCl2 | CaSO4 |
| 36.3 | 27.0 | 11.1 | 41.4 | 40.8 | 78 | 51.7 | 26.2 | 0.165 |
查看答案和解析>>
科目:高中化学 来源:2012年人教版高中化学选修6 2.1 物质的分离和提纯练习卷(解析版) 题型:实验题
实验室可用NH4HCO3和NaCl为原料制备纯碱。请根据下表数据和实验步骤,回答下列问题: 30℃时几种盐的溶解度/g
|
NaCl |
NH4HCO3 |
NaHCO3 |
NH4Cl |
Na2SO4 |
|
CaCl2 |
MgCl2 |
CaSO4 |
|
36.3 |
27.0 |
11.1 |
41.4 |
40.8 |
78 |
51.7 |
26.2 |
0.165 |
制备纯碱的步骤如下:
① 配制50 mL约25%的粗食盐水溶液(密度近似为1 g/cm3)。
② 精制食盐水(粗食盐中含有少量Ca2+、Mg2+、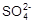 等杂质)用盐酸将滤液的pH值调至7。
等杂质)用盐酸将滤液的pH值调至7。
③ 加热食盐水,将溶液温度控制在30 ─ 35℃。
④ 在不断搅拌下,分次将研细的NH4HCO3加入食盐水中,加完料后,继续保温、 搅拌半小时。
⑤ 静置,趁热过滤,回收母液。晶体用蒸馏水洗涤两次。
⑥ 将晶体灼烧,得到纯碱。
(1)步骤①中,配制溶液的最后一步操作是______________________;
(2)步骤②中,SO42-是否需要除去?_________,理由是________________
(3)步骤④中所有操作的共同目的是_____________;
(4)步骤⑤中晶体的洗涤液中主要含有的杂质阳离子是____________,在通常情况下,检验这种阳离子的方法_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com