
 小明和同班同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
小明和同班同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.分析 (1)根据金属活动性顺序表可以判断钠、钾、镁、铝的活泼性,活泼性越强,与盐酸反应越剧烈;根据电子守恒比较生成氢气体积大小;
(2)硫离子被氯气氧化成硫单质,据此写出反应的离子方程式;
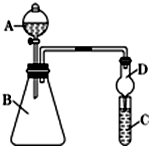
(3)①根据仪器的构造写出仪器B的名称;球形干燥管具有防止倒吸的作用;
②碳酸酸性强于硅酸,二氧化碳能够与硅酸钠反应生成白色沉淀硅酸;除去二氧化碳中氯化氢,可以使用饱和碳酸氢钠溶液.
解答 解:(1)金属活泼性顺序为:钾>钠>镁>铝,所以相同条件下与盐酸反应最激烈的是钾,反应速率最慢的是铝;生成1mol氢气需要得到2mol电子,1mol钾、钠都失去1mol电子,1mol镁失去2mol电子,而1mol铝失去3mol电子,所以生成氢气最多的是金属铝,
故答案为:钾;铝;铝;
(2)氯气氧化性强于硫单质,所以氯气能够与硫离子反应生成硫,反应的离子方程式为:S2-+Cl2═S↓+2Cl-,
故答案为:S2-+Cl2═S↓+2Cl-;
(3)①仪器B为锥形瓶;球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中,
故答案为:锥形瓶,倒吸;
②氯化氢具有挥发性,干扰实验结果,需要将二氧化碳中的氯化氢除掉,根据氯化氢与碳酸氢钠反应,而二氧化碳不反应,可以在B和C之间增加装有饱和NaHCO3溶液的洗气瓶,
故答案为:有白色沉淀生成;饱和NaHCO3.
点评 本题考查物质的性质实验,为高考常见题型和高频考点,侧重探究金属单质的金属性强弱、非金属单质的非金属性强弱方法,题目难度中等,正确掌握判断金属性、非金属性强弱的方法,明确除杂试剂的作用原则:除去装置,不能引进新的杂质.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 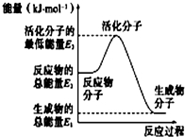 反应②中的能量变化如图所示,则△H2=E1-E3 | |
| B. | H2的燃烧热为241.8 kJ•mol-1 | |
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 | |
| D. | 氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=+906 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知A、B、C、D四种元素均为短周期元素,原子序数依次递增,E为前30号元素.5种元素的部分特点:
已知A、B、C、D四种元素均为短周期元素,原子序数依次递增,E为前30号元素.5种元素的部分特点:| 元素 | 特 点 |
| A | 其气态氢化物呈三角锥形,水溶液显碱性 |
| B | 基态原子核外有三个能级,其中最外层电子数等于次外层电子数的3倍 |
| C | 基态原子占据两种形状的原子轨道,且最外层电子数等于最内层电子数 |
| D | 元素原子的外围电子层排布式为nsn-1npn-1 |
| E | 原子M能级层为全充满状态且核外的未成对电子只有一个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 结构简式 | 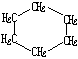 | 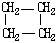 | Br-CH2-CH2-CH(CH3)-CH2-Br |
| 键线式 | 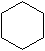 (环己烷) (环己烷) |  (环丁烷) (环丁烷) |  |

 (不需注明反应条件)
(不需注明反应条件)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液和浓硫酸的洗气瓶 | |
| B. | 用图1所示装置可从KI和I2的固体混合物中回收I2 | |
| C. | 用图2所示装置蒸干FeSO4饱和溶液来制备FeSO4•7H2O | |
| D. | 用图3所示装置除去Cl2中含有的少量HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com