
分析 (1)比较两种元素的非金属性强弱,可根据单质之间的置换反应、与氢气反应的难易程度、氢化物的稳定性以及最高正价氧化物对应水化物酸性强弱,据此分析;
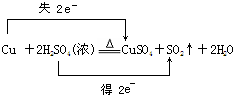
(2)KMnO4与浓盐酸反应生成氯气,氯气具有强氧化性,能将碘离子氧化为碘单质,碘遇淀粉试液变蓝色,由此分析解答;
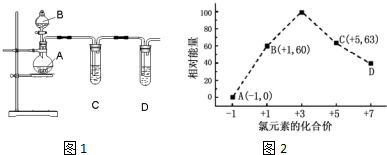
(3)①根据图2可知,D中Cl元素化合价为+7价,根据ClOX-中化合价代数和为-1判断x值;
②B→A+C,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,反应热=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol,据此答题;
解答 解:(1)比较两种元素的非金属性强弱,可根据单质之间的置换反应、与氢气反应的难易程度、氢化物的稳定性以及最高正价氧化物对应水化物酸性强弱,
①Cl2、Br2、I2的颜色逐渐加深,是物理性质,不能比较非金属性强弱;
②Cl2、Br2、I2的氧化性逐渐减弱,说明非金属性减弱;
③HCl、HBr、HI的酸性不能判断非金属性强弱;
④HCl、HBr、HI的热稳定性逐渐减弱,说明非金属性减弱;
⑤Cl2、Br2、I2和H2反应条件由光照(或点燃)→一定温度→持续加热;条件由易到难,说明非金属性减弱;
⑥AgCl、AgBr、AgI的颜色逐渐加深,与非金属性强弱无关,
故选②④⑤;
(2)KMnO4与浓盐酸反应生成氯气,氯气与淀粉碘化钾混合溶液反应生成碘单质,碘遇淀粉试液变蓝色,故C中溶液变为蓝色,
氯气与淀粉碘化钾混合溶液反应离子方程式为:Cl2+2I-═2Cl-+I2,则证明了非金属性:Cl>I,所以烧瓶A中应盛放的药品是
KMnO4,管C中应盛放的药品是粉碘化钾溶液,则装置D的作用是用氢氧化钠吸收多余的氯气,当观察到现象溶液变为蓝色可证明非金属性Cl>I,
故答案为:⑥;⑤;吸收未反应完的氯气,防止污染环境;C中溶液变蓝;
(3)①根据图象知,D中Cl元素化合价为+7价,所以ClOx-中x为4,则D为ClO4-,故答案为:ClO4-;
②B→A+C,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,反应热=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol,所以生成1molClO3-时,放出117kJ的热,
故答案为:3ClO-=ClO3-+2Cl-;放出117.
点评 本题考查实验方案设计,涉及非金属性强弱的比较,反应热的有关计算等,明确物质的性质是解本题关键,同时考查学生灵活运用知识解答问题的能力,题目难度中等.


科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液中滴入足量氢氧化钙溶液:HCO3-+OH-=CO32-+H2O | |
| B. | 硅酸钠溶液与足量CO2反应:SiO32-+CO2+H2O=H2SiO3↓+CO32- | |
| C. | FeBr2溶液中通入足量的Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH-=2AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g O2中含有32NA个电子 | |
| B. | 22.4L N2含有阿伏加德罗常数个氮分子 | |
| C. | 在标准状况下,22.4L水的质量约为18g | |
| D. | 常温常压下22g的CO2与标准状况下11.2L HCl含有相同的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量25.20g氯化钠固体 | |
| B. | 分液时,上层液体从分液漏斗下口流出 | |
| C. | 在制取蒸馏水的实验中收集冷凝水时,应弃去开始蒸馏出的部分 | |
| D. | 在制取蒸馏水的实验中,冷水从冷凝管上口入,下口出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com