
【题目】已知常温下反应:Fe3++AgFe2++Ag+的平衡常数K=0.3。现将含0.010mol/LFe(NO3)2和0.10mol/L Fe(NO3)3的混合溶液倒入烧杯甲中,将含0.10mol/L的AgNO3溶液倒入烧杯乙中(如图),闭合开关 K,关于该原电池的说法正确的是
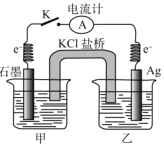
A.原电池发生的总反应中Ag+氧化Fe2+
B.盐桥中阳离子从左往右作定向移动
C.石墨为负极,电极反应为Fe2+-e-= Fe3+
D.当电流计指针归零时,总反应达到平衡状态
【答案】D
【解析】
A.根据浓度商Qc和平衡常数K大小判断反应进行方向,从而确定原电池的正负极。由Fe3+、Fe2+及Ag+的浓度,可求得![]() ,Qc小于K,所以反应Fe3++AgFe2++Ag+正向进行,即原电池总反应为Fe3++Ag=Fe2++Ag+,Fe3+作氧化剂,氧化了Ag,A错误;
,Qc小于K,所以反应Fe3++AgFe2++Ag+正向进行,即原电池总反应为Fe3++Ag=Fe2++Ag+,Fe3+作氧化剂,氧化了Ag,A错误;
B.根据A项分析,Ag失去电子,作还原剂,为负极,石墨作正极。在原电池中,阳离子向正极移动,因此盐桥中的阳离子是从右往左作定向移动,B错误;
C.根据A项分析,石墨作正极,石墨电极上发生反应,Fe3++e-=Fe2+,C错误;
D.当电流计读数为0时,说明该电路中无电流产生,表示电极上得失电子达到平衡,即该总反应达到化学平衡,D正确。
答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】大功率Al-H2O2动力电池(如图),下列说法不正确的是
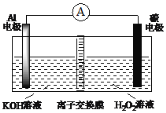
A. H2O2 在碳电极上发生还原反应
B. 碳电极附近溶液的pH增大
C. 溶液中OH-向负极移动
D. 负极反应式为Al-3e-+3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中,正确的是( )
A.向硝酸银溶液中加盐酸Ag++C1-=AgCl↓
B.酸化NaIO3和NaI的混合溶液:I-+IO3-+6H+=I2+3H2O
C.盐酸跟氢氧化镁反应:H++OH-=H2O
D.电解饱和食盐水:2Cl-+2H+![]() Cl2↑+H2↑
Cl2↑+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是元素周期表前四周期中的四种常见元素,其相关信息如下表:
是元素周期表前四周期中的四种常见元素,其相关信息如下表:
元素代号 | 相关信息 |
|
|
| 常温常压下, |
|
|
|
|
(1)![]() 位于元素周期表第__________周期第__________族。
位于元素周期表第__________周期第__________族。
(2)![]() 是一种常用的溶剂,
是一种常用的溶剂,![]() 的分子中存在个
的分子中存在个![]() 键。在
键。在![]() 、
、![]() 两种共价键中,键的极性较强的是_____________,键长较长的是___________。
两种共价键中,键的极性较强的是_____________,键长较长的是___________。
(3)写出![]() 元素的原子核外电子排布式:__________。
元素的原子核外电子排布式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有0.01molFeCl3的氯化铁饱和溶液因久置变得浑浊,将所得分散系从如图所示装置的 A 区流向B区,其中C区是不断更换中的蒸馏水。已知NA为阿伏加德罗常数的值。下列说法不正确的是
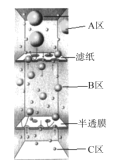
A.实验室制备 Fe(OH)3胶体的反应为:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
B.滤纸上残留的红褐色物质为Fe(OH)3固体颗粒
C.在B区的深红褐色分散系为Fe(OH)3胶体
D.进入C区的H+的数目为0.03NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,X、W为同一主族元素,Y是地壳中含量最高的元素。X、Z、W分别与Y形成的最高价化合物为甲、乙、丙。结合如图转化关系,下列判断错误的是
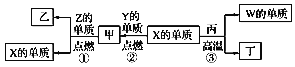
A.反应③为工业制粗硅的原理
B.Z位于元素周期表第三周期ⅡA族
C.4种元素的原子中,Y原子的半径最小
D.工业上通过电解乙来制取Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某有机物A的结构,做如下实验:
①将2.3g该有机物完全燃烧,生成0.1molCO2和2.7g水;
②用质谱仪测定其相对分子质量,得到如图1所示的质谱图;
③用核磁共振仪处理该化合物,得到如图2所示图谱,图中三个峰的面积之比是1∶2∶3。
试回答下列问题:
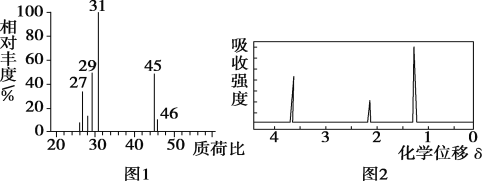
(1)有机物A的相对分子质量是__。
(2)写出有机物A的结构简式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
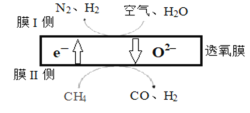
【题目】氢气是一种清洁能源。在冶金、电力、材料等领域应用广泛。请回答下列问题:
(1)某科研团队利用透氧膜获得N2、H2的工作原理如图所示(空气中N2和O2的物质的量之比为4:1)。上述过程中,膜I侧所得气体的物质的量之比为n(H2):n(N2)=3:1,则氧化作用的物质为_______________,膜Ⅱ侧发生的电极反应式为_________________
(2)用CO和H2合成甲醇的热化学方程式为CO(g)+2H2(g) CH3OH(g) △H1
已知CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=-49.0kJ/mol
CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.1kJ/mol
则△H1=________________
(3)向体积可变的密闭容器中充入1molCO和2.2molH2,在恒温恒压条件下发生反应:CO(g)+2H2(g) CH3OH(g),平衡时,CO的转化率α(CO)随温度、压强的变化情况如图1所示。
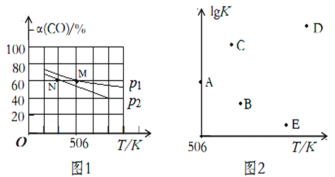
①压强p1_____(填“>”、“<”或“=”)p2;M点时,该反应的平衡常数Kp=______(用平衡分压表示,分压=总压×物质的量分数)
②不同温度下,该反应的平衡常数的对数值lgK如图2,其中A点为506K时平衡常数的对数值,则B、C、D、E四点中能正确表示该反应的lgK与温度(T)的关系的是_____________
(4)H2还原NO的反应为2NO(g)+2H2(g)N2(g)+2H2O(l),实验测得反应速率的表达式为v=k·cm(NO)·cn(H2)(k是速率常数,只与温度有关)。
①某温度下,反应速率与反应物浓度的变化关系如下表所示。
编号 | c(H2)/(mol·L-1) | c(NO)/(mol·L-1) | v/(mol·L-1·min-1) |
1 | 0.10 | 0.10 | 0.414 |
2 | 0.10 | 0.20 | 1.656 |
3 | 0.50 | 0.10 | 2.070 |
由表中数据可知,m=_______,n=_______。
②上述反应分两步进行:ⅰ2NO(g)+2H2(g) N2(g)+H2O2(l)(慢反应)
ⅱH2O2(l)+H2(g) 2H2O(l)(快反应)。下列说法正确的是_______
A. H2O2是该反应的催化剂 B. 总反应速率由反应ⅱ的速率决定
C. 反应ⅰ的活化能较高 D.反应ⅰ中NO和H2的碰撞仅部分有效
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com