
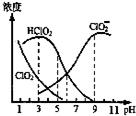
| A£® | Ź¹ÓĆøĆĘÆ°×¼ĮµÄ×ī¼ŃpHĪŖ3 | |
| B£® | pH=5Ź±£¬ČÜŅŗÖŠ$\frac{c£ØCl{{O}_{2}}^{-}£©}{c£ØHCl{O}_{2}£©}$ØT$\frac{1}{10}$ | |
| C£® | pH=7Ź±£¬ČÜŅŗÖŠŗ¬ĀČĪ¢Į£µÄÅØ¶Č“óŠ”ĪŖ£ŗc£ØHClO2£©£¾c£Ø ClO2-£©£¾c£Ø ClO2£©£¾c£Ø Cl-£© | |
| D£® | NaClO2ČÜŅŗ¼ÓĖ®Ļ”ŹĶĖłÓŠĄė×ÓÅØ¶Č¾ł¼õŠ” |
·ÖĪö A£®øł¾ŻĢāŅā£ŗHClO2ŗĶClO2¶¼¾ßÓŠĘÆ°××÷ÓĆ£¬½įŗĻĶ¼ÖŠHClO2ŗĶClO2µÄÅØ¶Č“óŠ”Ą“Č·¶ØŹ¹ÓĆøĆĘÆ°×¼ĮµÄ×ī¼ŃpH£»
B£®pH=6Ź±£¬c£ØHClO2£©=c£ØClO2-£©£¬$\frac{c£ØCl{{O}_{2}}^{-}£©}{c£ØHCl{O}_{2}£©}$£®c£ØH+£©ØTKa=10-6£¬ÓɵēĄėĘ½ŗā³£Źż¼ĘĖćpH=5Ź±$\frac{c£ØCl{{O}_{2}}^{-}£©}{c£ØHCl{O}_{2}£©}$£»
C£®øł¾ŻĶ¼ÖŖ£¬pH=7Ź±£¬c£ØHClO2£©£¼c£Ø ClO2-£©£»
D£®NaClO2ČÜŅŗ¼ÓĖ®Ļ”ŹĶ£¬ČÜŅŗ¼īŠŌ¼õČõ£¬Ōņc£ØOH-£©¼õŠ”£¬ĪĀ¶Č²»±ä£¬Ąė×Ó»ż³£Źż²»±ä£¬ÓÉ“ĖČ·¶Øc£ØH+£©±ä»Æ£®
½ā“š ½ā£ŗA£®øł¾ŻĢāŅā£ŗHClO2ŗĶClO2¶¼¾ßÓŠĘÆ°××÷ÓĆ£¬ŌņĶ¼ÖŠHClO2ŗĶClO2µÄÅضČÖ®ŗĶ×ī“óŹ±Ęư׊§¹ū×īŗĆ£¬ĖłŅŌøĆĘÆ°×¼ĮµÄ×ī¼ŃpHŌŚ1-3£¬¹ŹA“ķĪó£»
B£®pH=6Ź±£¬c£ØHClO2£©=c£ØClO2-£©£¬$\frac{c£ØCl{{O}_{2}}^{-}£©}{c£ØHCl{O}_{2}£©}$£®c£ØH+£©ØTKa=10-6£¬ÓɵēĄėĘ½ŗā³£Źż¼ĘĖćpH=5Ź±$\frac{c£ØCl{{O}_{2}}^{-}£©}{c£ØHCl{O}_{2}£©}$=$\frac{1{0}^{-6}}{1{0}^{-5}}$=0.1£¬¹ŹBÕżČ·£»
C£®øł¾ŻĶ¼ÖŖ£¬pH=7Ź±£¬“ęŌŚc£ØHClO2£©£¼c£Ø ClO2-£©£¬ŌņĄė×ÓÅØ¶Č“óŠ”Ė³ŠņŹĒc£Ø ClO2-£©£¾c£ØHClO2£©£¾c£Ø ClO2£©£¾c£Ø Cl-£©£¬¹ŹC“ķĪó£»
D£®NaClO2ČÜŅŗ¼ÓĖ®Ļ”ŹĶ£¬ČÜŅŗ¼īŠŌ¼õČõ£¬Ōņc£ØOH-£©¼õŠ”£¬ĪĀ¶Č²»±ä£¬Ąė×Ó»ż³£Źż²»±ä£¬Ōņc£ØH+£©Ōö“󣬹ŹD“ķĪó£»
¹ŹŃ”B£®
µćĘĄ ±¾ĢāŅŌĶ¼Ļó·ÖĪöĪŖŌŲĢåæ¼²éĄė×ÓÅØ¶Č“óŠ”±Č½Ļ£¬ĪŖøßĘµæ¼µć£¬²ąÖŲæ¼²éѧɜ·ÖĪöÅŠ¶Ļ¼°¼ĘĖćÄÜĮ¦£¬×¢ŅāøĆĢāÖŠµēĄėĘ½ŗā³£Źż¼ĘĖć·½·Ø£¬ŅדķŃ”ĻīŹĒB£®


 ĆūŹ¦Öøµ¼ĘŚÄ©³å“Ģ¾ķĻµĮŠ“š°ø
ĆūŹ¦Öøµ¼ĘŚÄ©³å“Ģ¾ķĻµĮŠ“š°ø æŖŠÄĶÜæŚĖćĢāæØĻµĮŠ“š°ø
æŖŠÄĶÜæŚĖćĢāæØĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŌŚæÕĘųÖŠ£¬øÖĢśÖĘĘ·ŗĶĀĮÖĘĘ·¶¼ČŻŅ×·¢ÉśĪüŃõøÆŹ“ | |
| B£® | ¾ŪŅŅĻ©ĖÜĮĻŅץĻ»Æ£¬ŹĒŅņĪŖ·¢ÉśĮĖ¼Ó³É·“Ó¦ | |
| C£® | Ź³Ę·°ü×°“üÖŠ³£·ÅČėŠ”“üµÄÉśŹÆ»Ņ£¬ÄæµÄŹĒ·ĄÖ¹Ź³Ę·Ńõ»Æ±äÖŹ | |
| D£® | æÕĘųÖŹĮæÖø±źÖŠÓŠŅ»ĻīÖø±źĆū³ĘĪŖPM2.5£¬ÖøµÄŹĒæÕĘųÖŠÖ±¾¶”Ü2.5Ī¢Ć׵ĹĢĢå»ņŅŗĢåµÄ×Ü³Ę |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
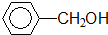 ·ÓĄą-OH
·ÓĄą-OH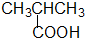 ōČĖįĄą-COOH
ōČĖįĄą-COOH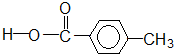 Č©Ąą
Č©Ąą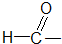
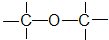
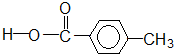 õ„Ąą
õ„Ąą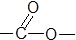
| A£® | ¢Ł¢Ś¢Ū¢Ü¢Ż | B£® | ¢Ś¢Ü | C£® | ¢Ś¢Ū¢Ü | D£® | ¢Ś¢Ü¢Ż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 23 gÄĘŌŚŃõĘųÖŠĶźČ«Č¼ÉÕŹ§µē×ÓŹżĪŖ0.5NA | |
| B£® | ±ź×¼×“æöĻĀ£¬22.4 L±½Ėłŗ¬µÄ·Ö×ÓŹż | |
| C£® | ŹŅĪĀĻĀ£¬8 g¼×Ķéŗ¬ÓŠ¹²¼Ū¼üŹżĪŖ2NA | |
| D£® | 1 L 1 mol•L-1ĮņĖįČÜŅŗĖłŗ¬µÄH+Źż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĢśÓėŃĪĖį·“Ó¦£¬ĢśŗĻ½š²»ÓėŃĪĖį·“Ó¦ | |
| B£® | “æĢśµÄÓ²¶ČŗĶĒæ¶Č¾łøßÓŚĢśŗĻ½š | |
| C£® | ²»ŠāøÖŹĒĢśŗĻ½š£¬Ö»ŗ¬½šŹōŌŖĖŲ | |
| D£® | Ņ»¶ØĢõ¼žĻĀ£¬Ģś·ŪæÉÓėĖ®ÕōĘų·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 æÉÄę·“Ó¦£ŗmA£Øg£©+nB£Øg£©?eC£Øg£©+fD£Øs£©£¬·“Ó¦¹ż³ĢÖŠ£¬µ±ĘäĖūĢõ¼ž²»±äŹ±£¬CµÄĢå»ż·ÖŹż[a£ØC£©]ŌŚ²»Ķ¬ĪĀ¶Č£ØT£©ŗĶ²»Ķ¬Ń¹Ēæ£ØP£©µÄĢõ¼žĻĀĖꏱ¼ä£Øt£© µÄ±ä»Æ¹ŲĻµČēĶ¼£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø””””£©
æÉÄę·“Ó¦£ŗmA£Øg£©+nB£Øg£©?eC£Øg£©+fD£Øs£©£¬·“Ó¦¹ż³ĢÖŠ£¬µ±ĘäĖūĢõ¼ž²»±äŹ±£¬CµÄĢå»ż·ÖŹż[a£ØC£©]ŌŚ²»Ķ¬ĪĀ¶Č£ØT£©ŗĶ²»Ķ¬Ń¹Ēæ£ØP£©µÄĢõ¼žĻĀĖꏱ¼ä£Øt£© µÄ±ä»Æ¹ŲĻµČēĶ¼£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø””””£©| A£® | »Æѧ·½³ĢŹ½ÖŠ£ŗm+n£¾e | |
| B£® | “ļµ½Ę½ŗāŗó£¬Ź¹ÓĆ“ß»Æ¼Į£¬CµÄĢå»ż·ÖŹż½«Ōö“ó | |
| C£® | “ļµ½Ę½ŗāŗó£¬ČōĪĀ¶ČÉżøߣ¬»ÆŃ§Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ | |
| D£® | “ļµ½Ę½ŗāŗó£¬ČōŌö“óĢåĻµµÄŃ¹Ē棬»ÆŃ§Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ²»ĶøĆ÷ | B£® | Ņ×ÓėŃõĘų·“Ó¦ | C£® | Ņ×µ¼ČČ | D£® | Ņ×µ¼µē |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com