
| A、90g | B、180g |
| C、270g | D、540g |
科目:高中化学 来源: 题型:
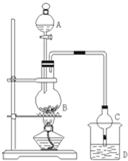 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
| 密度(g/cm3) | 0.714 | 0.789 | 1.049 | 0.903 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5mol/L |
| B、1.0mol/L |
| C、1.5mo l/L |
D、2.0 mo l/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解饱和食盐水阴极:Na++e-═Na |
| B、电解Na2SO4溶液阳极:4OH--4e-═2H2O+O2↑ |
| C、电解熔融NaCl 阴极:Na++e-═Na |
| D、电解NaOH溶液阳极:4OH--4e-═2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.2mX | ||
B、
| ||
| C、10mx | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
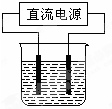 以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一.
以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一.查看答案和解析>>
科目:高中化学 来源: 题型:
| 4 |
| 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com