
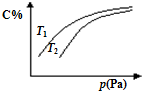
 在密闭容器中,对于可逆反应A+3B?2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是( )
在密闭容器中,对于可逆反应A+3B?2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是( )| A、若正反应方向△H<0,则T1>T2 |
| B、压强增大时,混合气体的密度减小 |
| C、A一定为气体 |
| D、B一定为气体 |


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
| 步骤 | 操 作 | 现 象 |
| (1) | 取少量溶液滴加几滴石蕊试液 | 溶液变蓝 |
| (2) | 另取少量溶液滴加过量氯水,再加入CCl4振荡,静置 | 上层无色,下层呈橙红色 |
| (3) | 取(2)上层溶液,加入过量Ba(NO3)2溶液和稀HNO3,过滤 | 有白色沉淀产生 |
| (4) | 向(3)的滤液中加入过量AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A、可能含有 Cl-、SO32-、SO42- |
| B、肯定没有 Ba2+、Cl-、Br- |
| C、不能确定 Na+、SO32-、SO42- |
| D、肯定含有 Na+、Br-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、溴乙烷与6mol/L的氢氧化钠水溶液共热:C2H5Br+OH-
| |||
| B、等物质的量浓度、等体积的Ca(HCO3)2溶液与氢氧化钠溶液相混合:Ca2++HCO3-+OH-═CaCO3↓+H2O | |||
| C、在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入1-2滴盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |||
D、500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某特定反应的平衡常数仅是温度的函数 |
| B、催化剂不能改变平衡常数的大小 |
| C、平衡常数发生变化,化学平衡必定发生移动 |
| D、化学平衡发生移动,平衡常数必发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
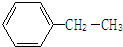
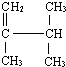
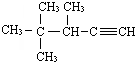
 表示的分子式
表示的分子式查看答案和解析>>
科目:高中化学 来源: 题型:
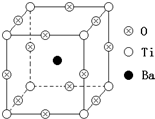 如图所示为PTC元件(热敏电阻)的主要成分--钡钛矿晶体结构,该结构是具有代表性的最小重复单位.该晶体经X射线分析鉴定,重复单位为正方体,边长a=403.1pm,顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.
如图所示为PTC元件(热敏电阻)的主要成分--钡钛矿晶体结构,该结构是具有代表性的最小重复单位.该晶体经X射线分析鉴定,重复单位为正方体,边长a=403.1pm,顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,1 mol羟基(-OH)所含的电子数为10 NA |
| B、由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2 g H2,则电路中通过0.2 mol电子 |
| C、在标准状况下,11.2 L NO与11.2 L 02混合后气体分子数为0.75 NA |
| D、l mol Na202,与足量水反应,转移电子的物质的量为2 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com