
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:实验题
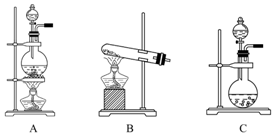 如表是实验室制备气体的有关内容:
如表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2-→O2 | |
| ② | 制氨气 | NH4Cl-→NH3 | |
| ③ | 制氯气 | HCl-→Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能用分液漏斗分离碘和四氯化碳的混合物 | |
| B. | 分液操作时,下层液体从分液漏斗下口放出,上层液体从上口倒出到另一个烧杯中 | |
| C. | 蒸发操作时,应使混合物中的水份完全蒸干后,才能停止加热 | |
| D. | 实验中不慎打破温度计,可用吹风机加快水银的蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
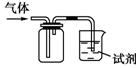 如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是( )
如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是( )| 选项 | 试剂 | 现象 | 结论 |
| A | 酸性KMnO4溶液 | 溶液褪色 | SO2有氧化性 |
| B | 品红溶液 | 溶液褪色 | SO2有漂白性 |
| C | NaOH溶液 | 无明显现象 | SO2与NaOH溶液不反应 |
| D | 紫色石蕊试液 | 溶液变红色后不褪色 | SO2有酸性,没有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com