
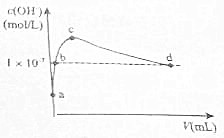
 在25℃下,向1L pH=10的KOH溶液中逐滴加酒石酸(酒石酸用H2T表示,其酸性略大于H2CO3).加入的酒石酸体积(y)与溶液中由1m由水电离出的c(0H-)的关系如图所示.下列叙述不正确的是( )
在25℃下,向1L pH=10的KOH溶液中逐滴加酒石酸(酒石酸用H2T表示,其酸性略大于H2CO3).加入的酒石酸体积(y)与溶液中由1m由水电离出的c(0H-)的关系如图所示.下列叙述不正确的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10m01•L-1 | |
| B. | b点溶液中:c(H+)=1×10-7m01•L-1 | |
| C. | c点溶液中:c(K+)>c(HT-)>c(T2-) | |
| D. | d点溶液中:c(K+)=2c(T2-)+c(HT-) |
分析 A、pH=10的KOH溶液水电离出的c(H+)=1×10-10mol•L-1;
B、在25℃时,水的离子积常数是1×10-14mol/L,由c(OH-)=1×10-7mol•L-1;
C、c点溶液中:水的电离促进程度最大,所以是K2T溶液;
D、d点溶液根据电荷守恒:c(K+)+c(H+)=2c(T2-)+c(HT-)+c(OH-),而d点溶液中c(H+)=c(OH-).
解答 解:A、pH=10的KOH溶液水电离出的c(H+)=1×10-10mol•L-1,故A正确;
B、在25℃时,水的离子积常数是1×10-14mol/L,由c(OH-)=1×10-7mol•L-1,所以c(H+)=1×10-7mol•L-1,故B正确;
C、c点溶液中:水的电离促进程度最大,所以是K2T溶液,所以离子浓度大小为:c(K+)>c(T2-)>c(HT-),故C错误;
D、d点溶液根据电荷守恒:c(K+)+c(H+)=2c(T2-)+c(HT-)+c(OH-),而d点溶液中c(H+)=c(OH-),所以c(K+)=2c(T2-)+c(HT-),故D正确;
故选C.
点评 本题考查了酸碱反应后溶液酸碱性分析判断,离子浓度大小比较,盐类水解,溶度积常数的计算分析,影响水电离的因素分析判断,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | c1:c2=3:1 | |
| B. | 平衡时,Y和Z的生成速率之比为2:3 | |
| C. | X、Y的转化率相等 | |
| D. | c1的取值范围为0 mol/L≤c1≤0.14 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
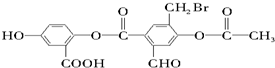 下列说法正确的是( )
下列说法正确的是( )| A. | 1 mol M最多能与10×22.4 L氢气(标准状况)发生加成反应 | |
| B. | 1 mol M最多能与2 mol Na HCO3反应 | |
| C. | 1 mol M最多能与5 mol NaOH反应 | |
| D. | 1 mol M最多能与2 mol Na反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的消耗量是3.0mol | |
| B. | N2的平均速率是0.5mol•(L•min)-1 | |
| C. | N2的平衡浓度是1.0mol•L-1 | |
| D. | N2反应的量占原物质的量的百分数是50% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子中3个碳原子在同一条直线上 | B. | 分子中所有原子都在同一平面上 | ||
| C. | 能使溴的四氯化碳溶液褪色 | D. | 能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
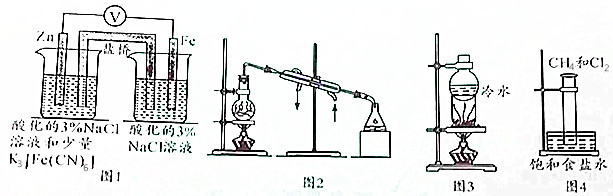
| A. | 用图1所示装置验证牺牲阳极的阴极保护法 | |
| B. | 用图2所示装置可在实验室制备蒸馏水 | |
| C. | 用图3所示装置可以进行NaCl与NH4Cl、NaCl与I2的分离 | |
| D. | 用图4所示装置进行CH4取代反应的实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
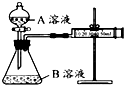 某实验小组利用 KMnO4 酸性溶液与弱酸 H2C2O4溶液反应进行“外界因素对反应速率 影响”的探究,设计实验方案如下:
某实验小组利用 KMnO4 酸性溶液与弱酸 H2C2O4溶液反应进行“外界因素对反应速率 影响”的探究,设计实验方案如下:| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.2mol/L-1 H2C2O4溶液 | 4mL 0.01mol/L-1 KMnO4溶液 |
| ② | 2mL 0.1mol/L -1H2C2O4溶液 | 4mL 0.01mol/L-1 KMnO4溶液 |
| 实验 编号 | 温度/℃ | 烧杯中所加的试剂及其用量 (mL) | 加入 少量固体 | 溶液褪色 时间(s) | |||
| 0.6mol•L-1 H2C2O4溶液 | H O | 0.2mol•L-1 KMnO4溶液 | 3mol•L-1 稀硫酸 | ||||
| ① | 25 | 30.0 | 20.0 | 30.0 | 20.0 | 无 | 1.8 |
| ② | 50 | V1 | V2 | 30.0 | 20.0 | 无 | 1.0 |
| ③ | 25 | 15.0 | V3 | 15.0 | 10.0 | 无 | 3.6 |
| ④ | 25 | 30.0 | 20.0 | 30.0 | 20.0 | K2SO4 | 1.8 |
| ⑤ | 25 | 30.0 | 20.0 | 30.0 | 20.0 | MnSO4 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
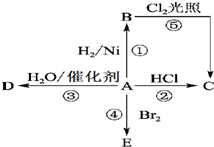 某气态烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A也是一种植物生长调节剂,A可发生如图所示的一系列化学反应.根据该图回答下列问题:
某气态烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A也是一种植物生长调节剂,A可发生如图所示的一系列化学反应.根据该图回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com