
X、Y两种元素形成含氧酸A和B,能说明酸A比酸B强的是
| A.酸A中X的非金属性比酸B中Y的非金属性强 |
| B.酸A中X与酸B中Y在同一周期,且X在Y之后 |
| C.酸A与酸B的铵盐溶液反应生成酸B |
| D.酸A具有强氧化性,酸B没有强氧化性 |
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:单选题
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。
请回答下列问题:
(1)元素D在周期表中的位置 。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示) 。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有 。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式: 。
若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式: 。
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
依据元素周期表示元素周期律,下列推断正确的是( )
| A.H3BO3的酸性比H2CO3的强 |
| B.Mg(OH)2的碱性比Be(OH)2的强 |
| C.HCl, HBr, HI的热稳定性依次增强 |
| D.若M+ 和R2- 的核外电子层结构相同,则原子序数:R>M |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
不能比较氮和氧非金属性相对强弱的是
| A.氨气在氧气中燃烧生成氮气 | B.沸点:H2O>NH3 |
| C.NO中N为+2价,氧为-2价 | D.热稳定性:H2O>NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
114号元素的一种同位素是由俄罗斯科学家合成的,存在时间只有30s,其质量数为289,该原子的中子数与电子数之差为
| A.61 | B.114 | C.175 | D.289 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各组物质的性质比较中不正确的是
| A.热稳定性:SiH4>PH3>H2 S |
| B.酸性:HClO4>H2SO4>H3 PO4 |
| C.碱性:NaOH>Mg(OH)2>AI(OH)3 |
| D.氧化性:F2>C12>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列物质性质的变化规律中与共价键键能大小有关的是
①F2、Cl2、Br2、I2的熔点、沸点逐渐升高;②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石的硬度、熔点、沸点都高于晶体硅;④NaF、NaCl、NaBr、NaI熔点依次降低
| A.仅③ | B.①③ | C.②④ | D.②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z是原子序数依次增大的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是( )
| A.原子半径:Z>Y>X |
| B.Z和X形成化合物的稳定性大于Z的同族元素与X形成化合物的稳定性 |
| C.Na2Y2与水发生反应时,Na2Y2只作氧化剂 |
| D.在CaX2、CaY2和CaZ2三种化合物中,阳离子与阴离子的个数比均为1∶2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
A、B、C三种短周期元素在周期表中的相对位置如图所示,已知A、C分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,则以下说法判断正确的是( )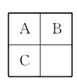
A.B与C均不存在同素异形体
B.X一定是酸性氧化物
C.B的氢化物比A、C的氢化物稳定
D.A与B形成的化合物X有3种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com