
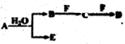
 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1-2种短周期元素组成,在一定条件下有如下转化关系,请外完成下列问题:
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1-2种短周期元素组成,在一定条件下有如下转化关系,请外完成下列问题:| 1 |
| 5 |
| 1 |
| 5 |
 ,二氧化碳分子为直线型,正负电荷中心重合,分子为非极性分子,Cl2与H2O反应的化学方程式为,Cl2+H2O=H++Cl-+HClO,
,二氧化碳分子为直线型,正负电荷中心重合,分子为非极性分子,Cl2与H2O反应的化学方程式为,Cl2+H2O=H++Cl-+HClO, ;非极性;Cl2+H2O=H++Cl-+HClO;
;非极性;Cl2+H2O=H++Cl-+HClO;| 1 |
| 5 |
| ||
| △ |
| ||
| △ |


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4 |
| B、HCl |
| C、NaOH |
| D、NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由H2、I2(g)、HI组成的平衡体系,加压(缩体积)后颜色加深 |
| B、开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| C、实验室中常用排饱和食盐水的方法收集氯气 |
| D、合成氨中增加N2的物质的量浓度可提高H2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在一定温度和压强下,各种气态物质体积大小由分子间距离决定 |
| B、相同温度时,CO2和N2O若体积相同,则它们的质量一定相同 |
| C、100g浓度为18mol/L的浓硫酸中加入等质量的水稀释浓度大于9mol/L |
| D、14 mol/L的H2SO4溶液的溶质质量分数为80%,那么7 mol/L的H2SO4溶液的溶质质量分数将大于40% |
查看答案和解析>>
科目:高中化学 来源: 题型:
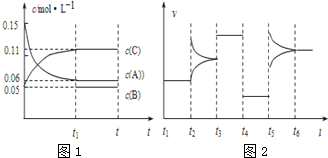
| A、若t1=15s,生成物C在 t0~t1时间段的平均反应速率为0.004 mol?L-1?s-1 |
| B、t4~t5阶段改变的条件为减小压强,t5~t6阶段改变的条件是升高化学反应的温度 |
| C、B的起始物质的量为0.02 mol |
| D、该化学反应的表达式为:3A(g)?B(g)+2C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如图:
二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com