
����Ŀ��H2S ��һ�ִ�����Ⱦ���ҵ�ϲ�ȡ���ַ������������ŷš�
(1)��ҵ�Ͽɲ�ȡ������H2S ��������H2S ���ŷš�������H2S ��ԭ��Ϊ:H2S + Fe2(SO4)3= S��+ 2FeSO4 + H2SO4 4FeSO4 +O2 +2H2SO4 ![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
�Իش���������:
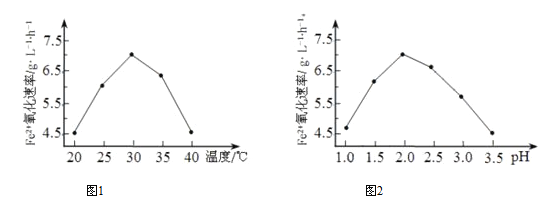
����˾�����ʱ��FeSO4����������������ʱ5.0��105�����þ���������_________��
������ͼ1��ͼ2 �ж�ʹ����˾����������Ϊ_________������Ӧ�¶ȹ��ߣ���Ӧ�����½�����ԭ����____________��
(2) �ʻ���(COS) ����ʯ����ҵ�����������DZ���У���������������Ʊ�����֮һ��H2S ��COS �ڸ����·�����Ӧ: H2S(g)+CO2(g)![]() COS(g)+H2O(g) ��610K ʱ����0.40mol H2S ��0.10molCO2����2.5 L �Ŀո�ƿ�У�H2S��ƽ��ת�������¶ȵĹ�ϵ��ͼ��ʾ:
COS(g)+H2O(g) ��610K ʱ����0.40mol H2S ��0.10molCO2����2.5 L �Ŀո�ƿ�У�H2S��ƽ��ת�������¶ȵĹ�ϵ��ͼ��ʾ:
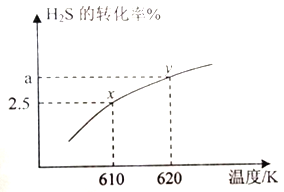
������˵���ܱ�����Ӧ�Ѵ�ƽ��״̬����__________��
A.H2S ��CO2�����ʵ���֮�ȱ��ֲ��� B.���������ܶȱ��ֲ���
C.��������ƽ����Է����������ٱ仯D.v��(H2S)=V��(COS)
���÷�Ӧ����H______0.(����>����<������=��)��x���Ӧ�¶��·�Ӧ��ƽ�ⳣ��K=_____(������λ��Ч����)��
����620K�ظ����飬��ƽ���ˮ�����ʵ�������Ϊ0.030.��H2S ��ת����a=_____%��
���𰸡� ���ͷ�Ӧ��ܣ����������� 30����pH=2.0 �����ʱ��ԣ�����˾�ʧȥ���ԣ� AD �� 2.8��10�C3����0.0028�� 3.75
����������1���ٸ�����˾�����ʱ��FeSO4������������Զ������ʱ�����ʿ�֪����˾��Ĵ��ڽ����˷�Ӧ�Ļ�ܣ�������������ͼ1��֪��30�������������������ͼ2��֪��pH=2.0ʱ���������������ʹ����˾����������Ϊ��30�桢pH=2.0������Ӧ�¶ȹ��ߣ���˾������ʱ���ʧȥ�������ԣ����Է�Ӧ�����½���
��2����A���ʼ0.40molH2S��0.10molCO2����ո�ƿ�У��ɻ�ѧ����ʽ�ɵã�H2S��CO2��1��1�����ʵ���֮�ȷ�Ӧ������ֻҪ��ƽ�⣬H2S��CO2�����ʵ���֮�Ⱦͻ�ϱ仯����H2S��CO2�����ʵ���֮�ȱ��ֲ���ʱ˵���Ѿ��ﵽ��ѧƽ��״̬��A��ȷ��B����������غ㶨�ɣ�����������������䣬�ݻ����䣬���Ի��������ܶ�ʼ�ձ��ֲ��䣬���ܸ����ܶ��ж��Ƿ�ﵽƽ��״̬����B����C��÷�Ӧ�����������䡢���������䣬����ƽ����Է�������ʼ�ղ��䣬���ܸ���ƽ����Է��������ж��Ƿ�ﵽƽ��״̬����C����D�v��(H2S)=v��(COS)������Ϊv��(H2S)=v��(COS)����v��(H2S)=v��(H2S)�����Ѵﵽ��ѧƽ��״̬��D��ȷ�����ϣ�ѡAD������ͼ�ɵã��¶�����H2S��ת��������˵�����»�ѧƽ�������ƶ���������H>0��x��H2S��ת����Ϊ2.5%����Ӧ������Ϊ��0.40mol��2.5%=0.01mol���ɻ�ѧ����ʽ����ʼ���ʵ���������ʽ��

����K=![]() =
= ��2.8��10�C3����0.0028��(������λ��Ч����)��
��2.8��10�C3����0.0028��(������λ��Ч����)��
�۸÷�Ӧǰ���������ʵ������䣬��620K�ظ����飬��ƽ���ˮ�����ʵ�������Ϊ0.030����ˮ�����ʵ���Ϊ��(0.40mol+0.10mol)��0.030=0.015mol�����Է�Ӧ��H2SΪ0.015mol����H2S��ת����a=0.015mol��0.40mol��100%=3.75%��


 ������ÿ�ʱ��ҵϵ�д�
������ÿ�ʱ��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A,B,C,D,E��Ϊ������Ԫ�أ�A�����ԭ��������С��Ԫ�أ�B��+1�������Ӻ�C�ĩ�1�������Ӷ�����ԭ�Ӿ�����ͬ�ĵ��Ӳ�ṹ��D��C����һ���ڣ�����B�γ�BD�����ӻ����E��CΪͬһ����Ԫ�أ�������������Ӧ��ˮ����Ϊһ��ǿ�ᣮ�����������Ϣ�ش��������⣺
��1��BԪ����Ԫ�����ڱ��е�λ���ǵ������壻
��2������CԪ�ص�ԭ�ӽṹʾ��ͼ��
��3����E���⻯�������������������ȵķ���������һ�����ѧʽ����ͬ��������������
��4��A��D�γɵĻ������к��л�ѧ���������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E���Ƕ���������Ԫ�أ���ԭ��������������A��Bͬ���ڣ�A��Dͬ���壬Aԭ���������������ڲ�������Ķ�����BԪ������������������������B����������C�������ӵ��Ӳ�ṹ��ͬ��C�ĵ�����B�ĵ����ڲ�ͬ�����·�Ӧ��������C2B��C2B2,E������������ԭ�Ӱ뾶��С��Ԫ�أ���ش�:
��1��D��Ԫ�����ڱ��е�λ����___________��
��2��C2B2�ĵ���ʽ��________
��3��B��C��E�����Ӱ뾶�ɴ�С��˳��Ϊ________(�����ӷ��Żش�); A��D��EԪ������������Ӧˮ�����������ǿ����Ϊ_________(�û�ѧʽ�ش���ͬ),B����̬�⻯����H2S��ȷе�ߵ���_____
��4��д��D��������������ᷴӦ�Ļ�ѧ����ʽ____________
��5��ˮ���̺�����������ʹ��ߺ�����Ⱦɫ��ʹˮ������ζ��EB2����������ȥˮ�г����Mn2+,���ɺ�ɫ����MnO2,������13.50g EB2ʱ����ת����lmol���ӣ���Ӧ�����ӷ���ʽ__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ,����˵����ȷ����
A. 2.4 gþԭ�ӱ������ʱ,ʧȥ�ĵ�����Ϊ0.3NA
B. ���³�ѹ��,28 g����������ԭ����Ϊ2NA
C. 18 g H218O�к��е�ԭ������Ϊ3NA
D. 32 g������4 g��������ԭ����Ŀ���,��ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ҹ�������н�ֹ����ʹ�ú�Ǧ���ͣ�����Ҫԭ����( )
A.������͵�ȼ��Ч��
B.�������ͳɱ�
C.����Ǧ��Ⱦ����
D.Ǧ��Դ��ȱ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ����٤��������ֵ������˵����ȷ���ǣ� ��
A.1L 0.1mol/L�İ�ˮ����0.1NA��NH4+
B.17 g H2O2���8NA������
C.7.8g Na2S��7.8g Na2O2������������ȣ���Ϊ0.3 NA
D.��״���£�22.4LNO��11.2LO2��Ϻ�����ķ�����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ķ�������������Ԫ�ص������Ϣ��
Ԫ�ش��� | �����Ϣ |
A | A�ĵ���������ˮ���ҷ�Ӧ���õ�ǿ������Һ |
B | B��ԭ�����������������ڲ������������ |
C | �ڵ�3����Ԫ���У�C�ļ����Ӱ뾶����С |
D | A��B��D��ɵ�36���ӵĻ�����X�Ǽ�������������Ҫ�ɷ� |
E | �����л����ж�����EԪ�� |
��ش�
��1��д��E��Ԫ�����ڱ��е�λ�ã���C�ļ����ӵĽṹʾ��ͼ�� ��
��2��X�Ļ�ѧʽΪ ��
��3��A,B,C����Ԫ�صļ����ӵİ뾶�ɴ�С��˳��Ϊ�������ӷ��ű�ʾ����
��4��A,B��Ԫ����ɵĻ�����A2B2����������ӡ����ۡ��������
��5��CԪ���γɵĵ�������A������������Ӧ��ˮ���ﷴӦ�������ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����U�ιܡ�����Ϊmg������������Ϊmg��̼����1L0.2mol��L-1CuCl2��Һ�����ͼ��ʾװ�ã�����˵������ȷ������ ��

A. ��K,���������Ϻ�ɫ��������
B. �պ�K,̼�������Ϻ�ɫ��������
C. �պ�K,̼�����淢���ĵ缫��ӦΪCu2++2e-=Cu
D. �պ�K,����·����0.3NA������ͨ��ʱ��������̼����������������Ϊ9.6g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ����Һ�����ܺ����������ӣ�Mg2+��A13+��Fe3+��Ba2+��H+��NH4+��SO42-��HCO3-��Cl-��ȡ����Һ��������ʵ�飺��ȡ��Һ����������AgNO3��Һ������ɫ��������ȡ��Һ����������BaCl2��Һ������ɫ��������������ϡ����������ܽ⣻��ȡһ������ԭ��Һ������һ�ֵ���ɫ��ĩ״�Ĺ���X��������������ʵ���(n����)�����������ʵ�����n����������뵭��ɫ��ĩ������nx���Ĺ�ϵ����ͼ��ʾ���������ɵ�����ȫ���ݳ�����

����ʵ����������ݷ�����ȷ����
A. ��Һ�п϶��������ڵ�������ֻ��Mg2+��A13+��NH4+
B. ��Һ�п϶�û�е�����ֻ��Fe3+��Ba2+
C. ������0.6mol����ɫ��ĩʱ,������������ֱ�ΪNH3��O2,���Ӧ�������Ϊ2:3
D. ��Һ�п��ܴ���Cl-��HCO3-
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com