
下列有关性质的比较,不能用元素周期律解释的是
A. 酸性:H2SO4 >HClO B. 金属性:Na>Mg
C. 碱性:KOH>NaOH D. 热稳定性:HC1>HBr
科目:高中化学 来源:2016-2017学年广东省肇庆市高二上学期期末化学试卷(解析版) 题型:计算题
工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60 mol H2(g),2min在某温度下达到平衡,此时NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。请计算(写出计算过程):
2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60 mol H2(g),2min在某温度下达到平衡,此时NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。请计算(写出计算过程):
(1)2min内N2的平均速率;
(2)该条件下此反应的平衡常数K。
查看答案和解析>>
科目:高中化学 来源:2017届吉林长春外国语学校高三上期末化学试卷(解析版) 题型:选择题
“类推”这种思维方法在化学学习与研究中有时会产生错误结 论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中错误的是
论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中错误的是
A.Fe与Cl2反应生成FeCl3,则Fe与I2反应可生成FeI3
B.Al(OH)3、Cu(OH)2受热易分解,则Fe(OH)3受热也易分解
C.Na可与冷水反应产生氢气,K也可与冷水反应生成氢气
D.CO2可以使澄清的石灰水变浑浊,SO2也可以使澄清的石灰水变浑浊
查看答案和解析>>
科目:高中化学 来源:2017届北京市丰台区高三上学期期末化学试卷(解析版) 题型:填空题
游泳池的水变绿主要是因为细菌及藻类的急剧繁殖导致的。
(1)含氯物质可以作为游泳池的消毒剂。一般水质正常的游泳池消毒后水中的余氯应保持在0.3~0.5mg/L,pH保持在7.4~7.6,这个环境下细菌和藻类都不易生长和繁殖。
①露天游泳池水由于连续下雨和高温(28~30℃)会导致藻类大量繁殖,其原因是_____________。
②消毒剂的错误使用也会导致藻类大量繁殖,游泳池水变绿。若水中的余氯以次氯酸形式存在,再加入H2O2进行消毒也会导致池水变绿,写出次氯酸与H2O2发生反应生成盐酸的化学方程式_________________。
(2)处理池水变绿的方法分为五步。
①灭藻原理是铜离子可以使叶绿体中毒无法光合作用而死亡;CuSO4溶液也能够杀菌,其原理是_________。加入CuSO4溶液后需要打开水循环系统,其作用是_____________。
②含氯消毒剂杀菌消毒主要体现出的化学性质是_____________。
③选用Na2CO3调节pH至7.5,用化学用语和文字解释其原因_____________。
④聚合氯化铝可将悬浮物和被杀灭的细小藻类沉淀到池底,第二天将池底沉淀移出。稀释聚合氯化铝会产生胶体,其离子反应方程式是_____________;当温度大于80℃时,水体中铝离子的总浓度会降低,其原因是_____________。
查看答案和解析>>
科目:高中化学 来源:2017届北京市丰台区高三上学期期末化学试卷(解析版) 题型:选择题
聚乙炔能够导电,下列关于聚乙炔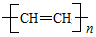 和聚合物A
和聚合物A 的说法中正确的是
的说法中正确的是
A.两种聚合物的单体互为同系物
B.聚合物A不属于单双键交错的结构
C.聚合物A的相对分子质量是聚乙炔的两倍
D.1 mol两种聚合物的单体分别与Br2发生加成反应,最多消耗Br2的物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源:2017届北京市昌平区高三上学期期末化学试卷(解析版) 题型:实验题
某小组同学欲探究0.1 mol/L Fe3+溶液与 0.1 mol/L S2-溶液的反应。小组同学先进行理论预测,提出如下三种可能:
a.Fe3+与 S2-发生复分解反应
b.Fe3+与 S2-发生 反应
c.Fe3+与 S2-发生互促水解反应
(1)依据预测a 写出该反应的离子方程式
(2)将预测b补充完整 ,说明预测依据 。
在进行实验验证前,先进行资料收集,得到如下信息:
物质 | 颜色 | 水中溶解性 |
Fe2S3 | 黑色 | 难溶于水 |
FeS | 黑褐色 | 难溶于水 |
进行如下实验:
实验步骤 | 操作 | 现象 | 备注 |
1 | 向2 mL 0.1 mol/L氯化铁溶液中逐滴滴入3滴0.1 mol/L 硫化钠溶液 | 产生黑色沉淀, 立即变为黄色沉淀,未见其它明显现象 | 自始至终都未见红褐色沉淀 |
2 | 继续滴加3滴0.1 mol/L 硫化钠溶液 | 同上 | |
3 | 继续滴加0.1 mol/L 硫化钠溶液至过量 | 产生黑色沉淀,振荡后静置,未发现明显变化 |
(3)写出黑色沉淀转变为黄色沉淀的离子方程式
为进一步探究反应实质,该组同学进行了如下实验:
实验步骤 | 操作 | 现象 |
4 | 向2 mL 0.1 mol/L硫化钠溶液中逐滴滴入3滴0.1 mol/L 氯化铁溶液 | 产生黑色沉淀,未见其它明显现象 |
5 | 继续滴加3滴0.1 mol/L 氯化铁溶液 | 同上 |
6 | 继续滴加0.1 mol/L 氯化铁溶液至过量 | 同上 |
(4)步骤4与步骤1现象不同的原因可能是
(5)有同学认为步骤3中产生的黑色沉淀中可能有FeS。请判断他的想法是否合理并说明理由
(6)依据以上实验现象,可得出结论:_________________________。
查看答案和解析>>
科目:高中化学 来源:2017届北京市昌平区高三上学期期末化学试卷(解析版) 题型:选择题
下列关于如图装置说法中正确的是
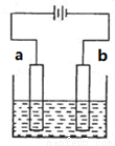
A.精炼铜时,a极为粗铜,b极为精铜
B.电镀铜时,a极为镀件,b极为铜
C.保护铁时,a极为铁片,b极为锌片
D.惰性电极电解饱和食盐水时,b极有黄绿色气体产生
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省长春市五县高二上期末化学试卷(解析版) 题型:填空题
在一定条件下,在密闭容器中充入1molSO2与2molNO2发生反应:SO2(g)+NO2(g) 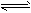 SO3(g)+NO(g) △H=-42kJ·mol-1。请回答下列问题。
SO3(g)+NO(g) △H=-42kJ·mol-1。请回答下列问题。
(1)恒温恒容下,在反应平衡体系中再充入一定量SO2,则NO2的平衡转化率__________(填“增大”、“不变”或“减小”,下同)。
(2)恒温恒压下,在反应平衡体系中再充入一定量SO2,则NO2的平衡浓度_________。
(3)恒容下,升高温度,上述反应的平衡常数K为_________。
(4)恒容下,降低温度,重新达到平衡时 _________。
_________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林省两省六校高一上期中化学试卷(解析版) 题型:选择题
① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶转移液体
A. ①和② B. ①和③ C. ③和④ D. ①和④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com