
X”¢Z”¢Q”¢R”¢T”¢U·Ö±š“ś±ķŌ×ÓŠņŹżŅĄ“ĪŌö“óµÄ¶ĢÖÜĘŚŌŖĖŲ”£XŗĶRŹōĶ¬×åŌŖĖŲ£»ZŗĶUĪ»ÓŚµŚVIIA×壻XŗĶZæÉŠĪ³É»ÆŗĻĪļXZ4£»Q»łĢ¬Ō×ÓµÄs¹ģµĄŗĶp¹ģµĄµÄµē×Ó×ÜŹżĻąµČ£»TµÄŅ»ÖÖµ„ÖŹŌŚæÕĘųÖŠÄܹ»×ŌČ¼”£
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©R»łĢ¬Ō×ӵĵē×ÓÅŲ¼Ź½ŹĒ_____________________”£
£Ø2£©ĄūÓĆ¼Ū²ćµē×Ó¶Ō»„³āĄķĀŪÅŠ¶ĻTU3µÄĮ¢Ģå¹¹ŠĶŹĒ______”£
£Ø3£©XĖłŌŚÖÜĘŚŌŖĖŲ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļÖŠ£¬ĖįŠŌ×īĒæµÄŹĒ______(Ģī»ÆѧŹ½)£»ZŗĶUµÄĒā»ÆĪļÖŠ·Šµć½ĻøߵďĒ_____(Ģī»ÆѧŹ½)£»Q”¢R”¢UµÄµ„ÖŹŠĪ³ÉµÄ¾§Ģ壬ČŪµćÓÉøßµ½µĶµÄÅÅĮŠĖ³ŠņŹĒ_______(Ģī»ÆѧŹ½)”£
 £Ø4£©CuSO4ČÜŅŗÄÜÓĆ×÷T4ÖŠ¶¾µÄ½ā¶¾¼Į£¬·“Ó¦æÉÉś³ÉTµÄ×īøß¼Ūŗ¬ŃõĖįŗĶĶ£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ_______________________”£
£Ø4£©CuSO4ČÜŅŗÄÜÓĆ×÷T4ÖŠ¶¾µÄ½ā¶¾¼Į£¬·“Ó¦æÉÉś³ÉTµÄ×īøß¼Ūŗ¬ŃõĖįŗĶĶ£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ_______________________”£
”¾“š°ø”æ
£Ø1£©1s22s22p63s23p2»ņÕß[Ne] 3s23p2
£Ø2£©Čż½Ē׶ŠĪ
£Ø3£©HNO3£»HF£»Si£¾Mg£¾Cl2
£Ø4£©P4+10CuSO4+16H2O=10Cu+4H3PO4+10H2SO4
”¾½āĪö”æÓÉĢāŅāæÉÖŖX”¢Z”¢Q”¢R”¢T”¢U·Ö±šC”¢F”¢Mg”¢Si”¢P”¢Cl”£
£Ø1£©Si»łĢ¬Ō×ӵĵē×ÓÅŲ¼Ź½ŹĒ1s22s22p63s23p2»ņÕß[Ne] 3s23p2
£Ø2£©PCl3¼Ū²ćµē×Ó¶ŌĪŖ4¶Ō£¬»¹ÓŠŅ»øö¹Āµē×Ó¶Ō£¬ŌņµĆ¹¹ŠĶĪŖČż½Ē׶ŠĪ
£Ø3£©µŚ¶žÖÜĘŚĖįŠŌ×īĒæµÄĪŖHNO3£»HF·Ö×Ó¼äÄÜŠĪ³ÉĒā¼ü£¬¹Ź·Šµćøߣ»SiĪŖŌ×Ó¾§Ģ壬MgĪŖ½šŹō¾§Ģ壬Cl2ĪŖ·Ö×Ó¾§Ģ壬ŌņSi£¾Mg£¾Cl2
£Ø4£©ÓÉĢāŅāæÉµĆ£ŗP4+10CuSO4+16H2O=10Cu+4H3PO4+10H2SO4
”¾æ¼µć¶ØĪ»”æŌŖĖŲĶʶĻ ĪļÖŹ½į ¹¹”¢·Ö×Ó½į¹¹”¢¾§Ģå½į¹¹
¹¹”¢·Ö×Ó½į¹¹”¢¾§Ģå½į¹¹
”¾ĆūŹ¦µć¾¦”æ±¾Ģā½«ŌŖĖŲĶʶĻŗĶĪļÖŹ½į¹¹ÖŖŹ¶½įŗĻĘšĄ“漲锣“ÓĄśÄźæ¼ĢāĄ“æ“£¬³£¼ūŌŖĖŲ¼°Ęä»ÆŗĻĪļŹĒ֊ѧ»ÆѧµÄÖŲµć£¬Ņ²ŹĒѧĻ°»ÆѧµÄ»ł ±¾µć£¬ŌŚøßæ¼ÖŠŌŖĖŲ»ÆŗĻĪļŹĒæ¼²éµÄÖŲµć”£ŌŖĖŲ»ÆŗĻĪļŌŚøßæ¼ÖŠµÄ漲鷽Ź½Ö÷ŅŖÓŠĮ½ÖÖ£ŗŅ»ŹĒµ„¶Ąæ¼²éijŅ»×åŌŖĖŲµÄ½į¹¹”¢ŠŌÖŹ”¢ÖʱøŅŌ¼°ÓĆĶ¾µČ£»¶žŹĒ½«ŌŖĖŲ»ÆŗĻĪļµÄÖŖŹ¶Óė»ł±¾øÅÄī”¢»ł±¾ĄķĀŪ½įŗĻ£¬Óė»Æѧ¼ĘĖćĻą½įŗĻ£¬ÓėĪŽ»śĶʶĻĻą½įŗĻ£¬Óė»ÆѧŹµŃéĻą½įŗĻµČ£¬ĖüĆĒŹĒŅŌŌŖĖŲ»ÆŗĻĪļĪŖŌŲĢå½įŗĻ»ł±¾øÅÄī”¢»ł±¾ĄķĀŪ”¢»Æѧ¼ĘĖć”¢»ÆѧŹµŃéµČ½ųŠŠæ¼²é”£Ö÷ŅŖæ¼²é»Æѧ¼ü”¢Ąė×Ó¼ü”¢¹²¼Ū¼ü”¢¹²¼Ū¼üµÄ¼«ŠŌ”¢µē×ÓŹ½”¢½į¹¹Ź½µÄŹéŠ“”¢ĪļÖŹ½į¹¹ÓėŠŌÖŹµÄ¹ŲĻµ”¢ŌÓ»ÆĄķĀŪ”¢¼Ū²ćµē×Ó¶Ō»„³āĄķĀŪ”¢µēĄėÄÜ”¢µēøŗŠŌ”¢¾§Ģå½į¹¹µČÖŖŹ¶”£ŌŚø“Ļ°ÖŠŅ»¶ØŅŖÖŲŹÓŌŖĖŲ»ÆŗĻĪļÖŖŹ¶µÄø“Ļ°£¬²»½öŅŖ×¢Ņāø÷Ö÷×åŌŖĖŲÖŠµäŠĶŌŖĖŲ»ÆŗĻĪļµÄø“Ļ°£¬»¹ŅŖŌŚø÷×å¼ä¼ÜĘšĒÅĮŗ“Ó¶ųÄܹ»ČŚ»į¹įĶØ£¬¾ŁŅ»·“Čż”£
±¾µć£¬ŌŚøßæ¼ÖŠŌŖĖŲ»ÆŗĻĪļŹĒæ¼²éµÄÖŲµć”£ŌŖĖŲ»ÆŗĻĪļŌŚøßæ¼ÖŠµÄ漲鷽Ź½Ö÷ŅŖÓŠĮ½ÖÖ£ŗŅ»ŹĒµ„¶Ąæ¼²éijŅ»×åŌŖĖŲµÄ½į¹¹”¢ŠŌÖŹ”¢ÖʱøŅŌ¼°ÓĆĶ¾µČ£»¶žŹĒ½«ŌŖĖŲ»ÆŗĻĪļµÄÖŖŹ¶Óė»ł±¾øÅÄī”¢»ł±¾ĄķĀŪ½įŗĻ£¬Óė»Æѧ¼ĘĖćĻą½įŗĻ£¬ÓėĪŽ»śĶʶĻĻą½įŗĻ£¬Óė»ÆѧŹµŃéĻą½įŗĻµČ£¬ĖüĆĒŹĒŅŌŌŖĖŲ»ÆŗĻĪļĪŖŌŲĢå½įŗĻ»ł±¾øÅÄī”¢»ł±¾ĄķĀŪ”¢»Æѧ¼ĘĖć”¢»ÆѧŹµŃéµČ½ųŠŠæ¼²é”£Ö÷ŅŖæ¼²é»Æѧ¼ü”¢Ąė×Ó¼ü”¢¹²¼Ū¼ü”¢¹²¼Ū¼üµÄ¼«ŠŌ”¢µē×ÓŹ½”¢½į¹¹Ź½µÄŹéŠ“”¢ĪļÖŹ½į¹¹ÓėŠŌÖŹµÄ¹ŲĻµ”¢ŌÓ»ÆĄķĀŪ”¢¼Ū²ćµē×Ó¶Ō»„³āĄķĀŪ”¢µēĄėÄÜ”¢µēøŗŠŌ”¢¾§Ģå½į¹¹µČÖŖŹ¶”£ŌŚø“Ļ°ÖŠŅ»¶ØŅŖÖŲŹÓŌŖĖŲ»ÆŗĻĪļÖŖŹ¶µÄø“Ļ°£¬²»½öŅŖ×¢Ņāø÷Ö÷×åŌŖĖŲÖŠµäŠĶŌŖĖŲ»ÆŗĻĪļµÄø“Ļ°£¬»¹ŅŖŌŚø÷×å¼ä¼ÜĘšĒÅĮŗ“Ó¶ųÄܹ»ČŚ»į¹įĶØ£¬¾ŁŅ»·“Čż”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŌŚæĘѧŹ·ÉĻÖŠ¹śÓŠŠķ¶ąÖŲ“óµÄ·¢Ć÷ŗĶ·¢ĻÖ£¬ĪŖŹĄ½ēĻÖ“śĪļÖŹĪÄĆ÷µģ¶ØĮĖ»ł“”£®ŅŌĻĀ·¢Ć÷»ņ·¢ĻÖŹōÓŚ»ÆѧŹ·ÉĻÖŠ¹ś¶ŌŹĄ½ēÖŲ“ó¹±Ļ׵ďĒ£Ø£©
¢ŁŌģÖ½ ¢ŚÓ”Ė¢¼¼Źõ ¢Ū»šŅ©¢ÜÖøÄĻÕė ¢ŻĮ¶Ķ”¢Į¶Ģś”¢Į¶øÖ ¢ŽŗĻ³ÉÓŠ»śøß·Ö×Ó²ÄĮĻ ¢ßČĖ¹¤ŗĻ³ÉÅ£ŅȵŗĖŲ ¢ąĢį³öŌ×Ó©©·Ö×ÓĀŪѧĖµ£®
| A£® | ¢Ł¢Ś¢Ū¢Ü¢ą | B£® | ¢Ł¢Ū¢Ż¢ß | C£® | ¢Ś¢Ü¢Ž | D£® | ¢Ż¢Ž¢ß¢ą2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠø÷×éĄė×ÓÖŠµÄĄė×Ó£¬ÄÜŌŚČÜŅŗÖŠ“óĮæ¹²“ęµÄŹĒ£Ø£©
| A£® | Na+”¢Mg2+”¢Cl©”¢OH© | B£® | H+”¢Ca2+”¢CO32©”¢NO3© | |
| C£® | Cu2+”¢K+”¢SO42©”¢NO3© | D£® | Na+”¢HCO3©”¢OH©”¢Ca2+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
øł¾Ż±ķÖŠŠÅĻ¢£¬ÅŠ¶ĻŅŌĻĀŠšŹöÕżČ·µÄŹĒ
²æ·Ö¶ĢÖÜĘŚŌŖĖŲµÄŌ×Ó°ė¾¶¼°Ö÷ŅŖ»ÆŗĻ¼Ū
| ŌŖĖŲ“śŗÅ | L | M | Q | R | T |
| Ō×Ó°ė¾¶£Ænm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| Ö÷ŅŖ»ÆŗĻ¼Ū | £«2 | £«3 | £«2 | £«6”¢£2 | £2 |
A£®Ēā»ÆĪļµÄĪČ¶ØŠŌĪŖH2T£¼H2R”””””” B£®µ„ÖŹÓėĻ”ŃĪĖį·“Ó¦µÄ¾ēĮŅ³Ģ¶ČĪŖL£¼Q
C£®MÓėTŠĪ³ÉµÄ»ÆŗĻĪļ¾ßÓŠĮ½ŠŌ D£®L2+ÓėR2£µÄŗĖĶāµē×ÓŹżĻąµČ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻÖÓŠ²æ·Ö¶ĢÖÜĘŚŌŖĖŲµÄŠŌÖŹÓėŌ×Ó(»ņ·Ö×Ó)½į¹¹ČēĻĀ±ķ£ŗ
| ŌŖĖŲ±ąŗÅ | ŌŖĖŲŠŌÖŹÓėŌ×Ó(»ņ·Ö×Ó)½į¹¹ |
| T | ×īĶā²ćµē×ÓŹżŹĒ“ĪĶā²ćµē×ÓŹżµÄ3±¶ |
| X | ³£ĪĀĻĀ£¬µ„ÖŹĪŖĖ«Ō×Ó·Ö×Ó£¬·Ö×ÓÖŠŗ¬ÓŠ3¶Ō¹²ÓƵē×Ó¶Ō£¬Ęä¼ņµ„Ēā»ÆĪļµÄĖ®ČÜŅŗĻŌ¼īŠŌ |
| Y | M²ć±ČK²ćÉŁ1øöµē×Ó |
| Z | µŚ3ÖÜĘŚŌŖĖŲµÄ¼ņµ„Ąė×ÓÖŠ°ė¾¶×īŠ”µÄ£¬ĘäŃõ»ÆĪļ³ŹĮ½ŠŌ |
£Ø1£©»³öŌŖĖŲTŌ×Ó½į¹¹Ź¾ŅāĶ¼__________________________£»
£Ø2£©ŌŖĖŲYÓėŌŖĖŲZĻą±Č£¬½šŹōŠŌ½ĻĒæµÄŹĒ______(ÓĆŌŖĖŲ·ūŗűķŹ¾)£¬ĻĀĮŠ±ķŹöÖŠÄÜÖ¤Ć÷ÕāŅ»ŹĀŹµµÄŹĒ____(ĢīŠņŗÅ)£»
a£®Yµ„ÖŹµÄČŪµć±ČZµ„ÖŹµĶ b£®YµÄ»ÆŗĻ¼Ū±ČZµĶ
c£®Yµ„ÖŹÓėĖ®·“Ó¦±ČZµ„ÖŹ¾ēĮŅ d£®Y×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļµÄ¼īŠŌ±ČZĒæ
£Ø3£©T”¢X”¢Y”¢ZÖŠÓŠĮ½ÖÖŌŖĖŲÄÜŠĪ³É¼ČÓŠĄė×Ó¼üÓÖÓŠ·Ē¼«ŠŌ¹²¼Ū¼üµÄ»ÆŗĻĪļ£¬Š“³öøĆ»ÆŗĻĪļµÄ»ÆѧŹ½ĪŖ_______”£
£Ø4£©ŌŖĖŲTŗĶĒāŌŖĖŲŅŌŌ×ÓøöŹż±Č1”Ć1ŠĪ³ÉµÄ»ÆŗĻĪļµÄµē×ÓŹ½ĪŖ______£¬ŌŖĖŲZ×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļÓėŌŖĖŲYµÄ×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļµÄČÜŅŗĻą»„·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĖµ·ØÕżČ· µÄŹĒ
µÄŹĒ
A£®ŅŅĻ©µÄÄź²śĮæĶس£ÓĆĄ“ŗāĮæŅ»øö¹ś¼ŅµÄŹÆÓĶ»Æ¹¤·¢Õ¹Ė®Ę½
B£®ĆŗµÄøÉĮóŹōÓŚĪļĄķ±ä»Æ
C£®ŹÆÓĶĮŃ»ÆµÄÖ÷ŅŖÄæµÄŹĒ³żČ„ŹÆÓĶÖŠµÄŌÓÖŹ
D£®Ń¹ĖõĢģČ»ĘųŗĶŅŗ»ÆŹÆÓĶĘųµÄÖ÷ŅŖ³É·Ö¾łĪŖŅ»Ńõ»ÆĢ¼
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŅŃÖŖ2SO2+O2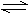 2SO3ŹĒŅ»øöÕż·“Ó¦·ÅČȵÄæÉÄę·“Ó¦”£Čē¹ū·“Ó¦ŌŚĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬ŌņĻĀĮŠÓŠ¹ŲĶ¾ŹöÕżČ·µÄŹĒ
2SO3ŹĒŅ»øöÕż·“Ó¦·ÅČȵÄæÉÄę·“Ó¦”£Čē¹ū·“Ó¦ŌŚĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬ŌņĻĀĮŠÓŠ¹ŲĶ¾ŹöÕżČ·µÄŹĒ
A£®Ź¹ÓĆ“ß»Æ¼ĮŹĒĪŖĮĖ¼Óæģ·“Ó¦ ĖŁĀŹ£¬ĢįøßÉś²śŠ§ĀŹ
ĖŁĀŹ£¬ĢįøßÉś²śŠ§ĀŹ
B£®ÉżøßĪĀ¶ČæɼÓæģÄę·“Ó¦ĖŁĀŹµ«²»ÄÜøıäÕż·“Ó¦ĖŁĀŹ
C£®Ņ»¶ØĢõ¼žĻĀ£¬SO2æÉ100%×Ŗ»ÆĪŖSO3
D£®ČĪŗĪĢõ¼žĻĀ£¬·“Ó¦“ļµ½Ę½ŗā£¬SO2µÄÅضČŅ»¶ØµČÓŚSO3µÄÅضČ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”°¾ĘŹĒ³ĀµÄĻć”±£¬¾ĶŹĒŅņĪŖ¾ĘŌŚ“¢“ę¹ż³ĢÖŠÉś³ÉĮĖÓŠĻćĪ¶µÄŅŅĖįŅŅõ„£¬ŌŚŹµŃéŹŅĪŅĆĒŅ²æÉŅŌÓĆĻĀĶ¼ĖłŹ¾µÄ×°ÖĆĄ“ÖĘČ”ŅŅĖįŅŅõ„”£ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
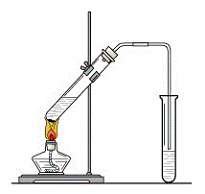 ””£Ø1£©Š“³öÓÉCH3COOHÓėC2H518OHÖĘČ”ŅŅĖįŅŅõ„µÄ»Æѧ·“Ó¦·½³ĢŹ½ £»øĆ·“Ó¦Źō£ß£ß£ß£ß·“Ó¦”£
””£Ø1£©Š“³öÓÉCH3COOHÓėC2H518OHÖĘČ”ŅŅĖįŅŅõ„µÄ»Æѧ·“Ó¦·½³ĢŹ½ £»øĆ·“Ó¦Źō£ß£ß£ß£ß·“Ó¦”£
””£Ø2£©øĆ·“Ó¦Šč¼ÓČėŅ»¶ØĮæµÄÅØĮņĖį£¬ŌņÅØĮņĖįµÄÖ÷ŅŖ×÷ÓĆŹĒ ”£
””£Ø3£©×°ÖĆÖŠĶØÕōĘųµÄµ¼¹ÜŅŖ²åŌŚ±„ŗĶĢ¼ĖįÄĘČÜŅŗµÄŅŗĆęÉĻ£¬²»ÄܲåČėČÜŅŗÖŠ£¬ÄæµÄŹĒ·ĄÖ¹”””””””””””””””””””£
””£Ø4£©ČōŅŖ°ŃÖʵƵÄŅŅĖįŅŅõ„·ÖĄė³öĄ“£¬Ó¦²ÉÓƵďµŃé²Ł×÷ŹĒ””””””””””””(Ģī²Ł×÷Ćū³Ę£©£»Ö÷ŅŖŹ¹ÓĆµÄ²£Į§ŅĒĘ÷ŹĒ ”££Ø“šŅĒĘ÷µÄĆū³Ę£©
””£Ø5£©Éś³ÉŅŅĖįŅŅõ„µÄ·“Ó¦ŹĒæÉÄę·“Ó¦£¬·“Ó¦Īļ²»ÄÜĶźČ«×Ŗ»Æ³ÉÉś³ÉĪļ£¬·“Ó¦Ņ»¶ĪŹ±¼äŗ󣬓ļµ½ĮĖ·“Ó¦µÄĻŽ¶Č£¬¼““ļµ½»ÆŃ§Ę½ŗāדĢ¬”£ĻĀĮŠĆčŹöÄÜĖµĆ÷ŅŅ“¼ÓėŅŅĖįµÄ·“Ó¦ŅŃ “ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄÓŠ(ĢīŠņŗÅ)”””””””””””””””””£
“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄÓŠ(ĢīŠņŗÅ)”””””””””””””””””£
””¢Łµ„Ī»Ź±¼äĄļ£¬Éś³É1molŅŅĖįŅŅõ„£¬Ķ¬Ź±Éś³É1molĖ®
””¢Śµ„Ī»Ź±¼äĄļ£¬Éś³É1molŅŅĖįŅŅõ„£¬Ķ¬Ź±Éś³É1molŅŅĖį
””¢Ūµ„Ī»Ź±¼äĄļ£¬ĻūŗÄ1molŅŅ“¼£¬Ķ¬Ź±ĻūŗÄ1molŅŅĖį
””¢ÜÕż·“Ó¦ĖŁĀŹÓėÄę·“Ó¦ĖŁĀŹĻąµČ
””¢Ż·“Ó¦»ģŗĻĪļÖŠø÷ĪļÖŹµÄÅØ¶Č²»ŌŁ ±ä»Æ
񄯒
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ(””””)
A£®Ģś±ķĆę¶ĘŠæ£¬Ģś×÷Ńō¼«
B£®“¬µ×ĻāĒ¶Šææ飬Šæ×÷øŗ¼«£¬ŅŌ·Ą“¬Ģå±»øÆŹ“
C£®øÖĢśĪüŃõøÆŹ“µÄÕż¼«·“Ó¦Ź½£ŗO2£«2H2O£«4e£===4OH£
D£®¹¤ŅµÉĻµē½ā±„ŗĶŹ³ŃĪĖ®µÄŃō¼«·“Ó¦Ź½£ŗ2Cl££2e£===Cl2”ü
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com