
下列叙述I和II均正确并且有因果关系的是
| 选项 | 陈述I | 陈述II |
| A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO |
| D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
科目:高中化学 来源: 题型:
设nA为阿伏加德罗常数的数值,下列说法正确的是( )
A.标准状况下,11.2 L的H2O中含有1.5nA个原子
B.0.1 mol·L-1 的(NH4)2SO4溶液中,所含NH4+数小于0.2nA
C.常温常压下,16 g的O2和O3混合气体中,含有8nA个电子
D.质量相同的N2和CO中,含有2nA个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
锌锰干电池由于其贮存和使用寿命较短,大都为一次性电池,用完之后被当作垃圾扔掉。这不仅浪费了宝贵的金属资源,而且还会产生严重的环境污染。下表是各类电池的综合成分分析结果:
| 元素 | 锌[来源:全,品…中&高*考+网] | 锰 | 铁 | 铜 | 碳 | 其它 |
| 质量百分含量 | 13~27 | 14~28 | 23~26 | 0.5~0.7 | 5~6 | 13 |
通过简单的机械处理,将电池中各组分进行最大在限度的分离,从而使整个处理过程得到简化。再分别对锌皮和锰粉(MnO2)进行湿法处理,通过预处理、浸取、净化等工序制出产品。工艺流程如下图:
查阅资料知各离子沉淀完全的pH为
| 离子 | Fe3+ | Fe2+ | Cu2+ | Mn2+ |
| pH | 3.2 | 9.0 | 6.7 | 10.1 |
已知:锌元素与铝元素相似,具有两性。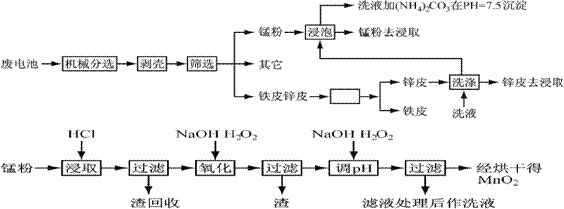
1、市售锌锰干电池为碱性电池,电解质溶液为KOH,则其正极反应为 ;
电极总反应方程为 ;
2、在预处理中,分离铁皮和锌皮的方法是 ,洗液加(NH4)2CO3在pH=7.5沉淀出一种碱式盐,该物质的化学式为 。
3、二氧化锰生产中,写出加入30%盐酸溶解时的离子方程式 ;盐酸溶解后回收的渣是 ;
4、已知第二次加H2O2后调节pH≈9的目的为将Mn2+转化为MnO2,则第一次加H2O2后调节pH≈5,目的是 ;
5、实验室中用高锰酸钾溶液检验Mn2+时,产生黑色沉淀,该反应的离子方程式为
;
6、硫酸锰在高温条件下可以得到三种氧化物,该热分解的方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
面对能源与环境等问题,
全球大力发展新能源的同时,还倡导节能减排、低碳经济。请回答下列问题:
Ⅰ、氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: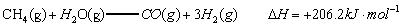
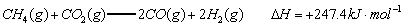
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。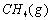 与
与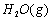 反应生成CO2(g)和
反应生成CO2(g)和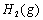 的热化学方程式为 。
的热化学方程式为 。
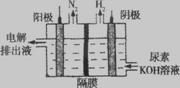
(2)电解尿素CO(NH2)2的碱性溶液制氢的装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为 。
(3)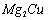 是一种储氢合金。350℃时,
是一种储氢合金。350℃时,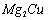 与
与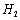 反
反
应,生成MgCu2和仅含一种金属元素的氢化物(其中
氢的质量分数为0.077)。则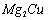 与
与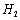 反应的化学
反应的化学
方程式为 。
Ⅱ、碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生可逆反应: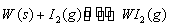 。为模拟该反应,在实验室中准确称取0.508 g碘、0.6992 g金属钨放置于50.0 mL密闭容器中,在一定温度下反应。如图是混合气体中的
。为模拟该反应,在实验室中准确称取0.508 g碘、0.6992 g金属钨放置于50.0 mL密闭容器中,在一定温度下反应。如图是混合气体中的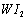 蒸气的物质的量随时间变化关系的图象
蒸气的物质的量随时间变化关系的图象 ,其中曲线I(0~t2时间段)的反应温度为450 ℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
,其中曲线I(0~t2时间段)的反应温度为450 ℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
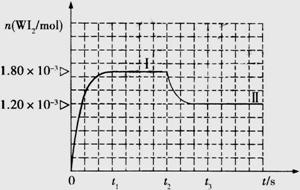
(4)该反应是 (填写“放热”或“吸热”)反应。在450℃时,该反应的平
衡常数K= 。
(5)若保持450℃温度不变,向该容器中再加入0.508 g碘,当再次达到平衡时,反应混合气体中I2的百分含量 (填“变大”、“不变”或“变小”)。
(6)若保持450℃温度不变,向该容器中再加入0.002 mol W、0.000 6 mol I2、0.0054 mol WI2,则化学平衡 (填“正向移动”、“不移动”或“逆向移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
含氮废水进入水体中对环境选成的污染越来越严重。某校环保小组的同学认为可以用金属铝将水中的NO3-还原成N2,从而消除污染。
(1) 配平以下有关的离子反应方程式:
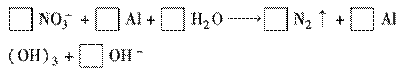
(2)以上反应中失电子的物质是________,还原产物是________,每生成1 mol这种还原产物,将有________电子发生转移。
(3)现需除去1  m3含氮0.3 mol的废水中的NO3-(设氮元素都以NO3-的形式存在),则至少需要消耗金属铝________。
m3含氮0.3 mol的废水中的NO3-(设氮元素都以NO3-的形式存在),则至少需要消耗金属铝________。
(4)你对以上治理污染的方案有何评价?
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氧化性Br2>Fe3+。FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:
a Fe2++b Br-+c Cl2→d Fe3++ e Br2+ f Cl-
下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
A. 2 4 3 2 2 6 B. 0 2 1 0 1 2
C. 2 0 1 2 0 2 D. 2 2 2 2 1 4
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室将NaClO3和Na2SO3按物质的量之比2∶1倒入烧瓶中,用水浴加热,同时滴入H2SO4,产生棕黄色气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为( )
A.Cl2 B.Cl2O
C.ClO2 D.Cl2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质应用的说法错误的是
A.玻璃容器可长期盛放各种酸 B.纯碱可用于清洗油污
C.浓氨水可检验氯气管道漏气 D.Na2S可除去污水中的Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
在配制一定物质的量浓度的盐酸溶液时,下列错误操作可能使所配溶液浓度偏高的是( )
A.未将烧杯和玻璃棒的洗涤液移入容量瓶
B.溶解搅拌时液体飞溅
C.用量筒量取浓盐酸时,仰视读数
D.定容时水加多了,用滴管吸出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com