
| A、10min内NO浓度变化表示的速率v(NO)=0.01 mol?L-1?min-1 |
| B、若保持其他条件不变,在恒压下进行该反应,则平衡时NO2的转化率大于50% |
| C、若升高温度,平衡逆向移动,则该反应的△H>0 |
| D、若起始时向容器中充入NO2(g)0.2mol、NO(g)0.1mol和Cl2(g)0.1mol(固体物质足量),则反应将向逆反应方向进行 |
| ||
| △t |
| ||
| △t |
| ||
| 10min |
| 0.1×0.12 |
| 0.24 |


科目:高中化学 来源: 题型:
| A、相同温度下,CuS在水中的溶解度比MnS小 |
| B、CuS和MnS一定都溶于强酸 |
| C、反应:Cu2+(aq)+MnS(s)═CuS(s)+Mn2+ K=7.5×1021 |
| D、在浓度均为0.01mol?L-1Cu2+和Mn2+混合溶液中,通入H2S只有MnS沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可与硝酸反应 | B、钠的化合物 |
| C、可溶于水 | D、电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤的干馏是物理变化,煤的气化和液化是化学变化 |
| B、煤油可由石油分馏获得,可用作燃料和保存少量金属钠 |
| C、沼气(主要成分是CH4)是可再生能源 |
| D、太阳能、氢能、风能、地热能、生物质能都是新能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
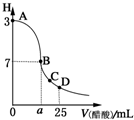 在25mL 0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1醋酸溶液,曲线如图所示,有关粒子浓度关系比较不正确的是( )
在25mL 0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1醋酸溶液,曲线如图所示,有关粒子浓度关系比较不正确的是( )| A、在D点,c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| B、在C点,c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C、在B点,a=12.5,且有c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| D、在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 | B、5 | C、9 | D、12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com