
| A、双氧水具有强氧化性,其稀溶液可用于清洗伤口 | B、14C可用于文物的年代鉴定,14C和12C互为同位素 | C、PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶 | D、自来水厂可使用Cl2和绿矾(FeSO4?7H2O)进行消毒、净化,以改善水质 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、对“地沟油”进行处理可以制得生物柴油,用作燃料 | B、高温可杀死H7N9型禽流感病毒,属于蛋白质的变性 | C、减少化石燃料燃烧和汽车尾气排放,是减少雾霾发生的有效措施之一 | D、SO2、Cl2等都用于织物漂白,它们的漂白原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成氨的“造气”阶段会产生废气 | B、电镀的酸性废液用碱中和后就可以排放 | C、电解制铝的过程中,作为阳极材料的无烟煤不会消耗 | D、使用煤炭转化的管道煤气比直接燃煤可减少环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽车尾气排放 | B、建筑扬尘 | C、煤燃烧 | D、风力发电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM2.5值越大,形成雾霾天气的可能性越大 | B、火电及北方冬季供暖烧煤所产生的废气是形成雾霾的一个重要因素 | C、氟氯烃作致冷剂会加剧雾霾天气的形成 | D、城市由于汽车尾气的大量排放,比农村形成雾霾的可能性大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、因为某碱性溶液的焰色呈黄色,所以其溶质为NaOH | B、煤燃烧时加入少量的石灰石可以减少废气中的二氧化硫排放 | C、CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | D、新制的亚硫酸溶液有酸性和漂白性,故滴入少量的紫色石蕊的现象是先变红,后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
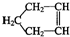 可简写为
可简写为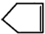 .降冰片烯的分子结构可表示为:
.降冰片烯的分子结构可表示为: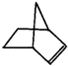
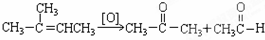
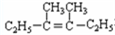 在上述类似条件下发生反应,请写出反应的方程式
在上述类似条件下发生反应,请写出反应的方程式查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com