
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
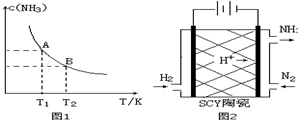
分析 (1)①由图1可知,温度越高,平衡时NH3的浓度越小,说明升高温度平衡向逆反应进行,平衡常数减小;
②令参加反应的氮气的物质的量为nmol,利用三段式用n表示处于平衡时各组分的物质的量,根据氨气的体积分数列方程计算n的值,再计算用N2表示的化学反应速率;
③根据平衡常数表达式带入平衡浓度计算T1温度下该反应的化学平衡常数K1;
(2)①N2(g)+3H2(g)=2NH3(g)△H1=a kJ/mol
②2H2(g)+O2(g)=2H2O(l)△H2=b kJ/mol
2×①-3×②,得:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),根据盖斯定律求△H;
(3)由图可知电解时,阴极与电源的负极相连,氮气在阴极得电子发生还原反应生成氨气,据此写出阴极反应;
(4)①弱电解质的电离平衡常数越小,其相应的弱离子水解程度越大,碳酸第二步电离平衡常数小于一水合氨电离平衡常数,则碳酸根离子水解程度大于一水合氨,据此判断碳酸钠溶液酸碱性;
②碳酸根离子水解程度大于铵根离子水解程度,碳酸氢根离子浓度大于一水合氨浓度,溶液中存在电荷守恒和物料守恒,结合电荷守恒、物料守恒和质子守恒判断.
解答 解:(1)①由图可知,温度越高,平衡时NH3的浓度越小,说明升高温度平衡向逆反应进行,平衡常数减小,故平衡常数KA>KB,温度越高,K值越小,所以正反应是放热反应,
故答案为:>;<;
②令参加反应的氮气的物质的量为nmol,则:
N2(g)+3H2(g)?2NH3(g)
开始(mol):1 3 0
变化(mol):n 3n 2n
平衡(mol):1-n 3-3n 2n
所以所以$\frac{2n}{(1-n)mol+(3-3n)mol+2nmol}$×100%=25%,解得n=0.4,这段时间内N2的化学反应速率为为:$\frac{\frac{0.4mol}{10L}}{5.00min}$=8.00×10-3mol/(L•min),
故答案为:8.00×10-3mol/(L•min);
③N2(g)+3H2(g)?2NH3(g)
开始(mol):1 3 0
变化(mol):0.4 1.2 0.8
平衡(mol):0.6 1.8 0.8
平衡浓度(mol/L) 0.06 0.18 0.08
K1=$\frac{{C}^{2}(N{H}_{3})}{c({N}_{2})•c{\;}^{3}({H}_{2})}$=$\frac{0.08{\;}^{2}}{0.06×0.18{\;}^{3}}$=18.3;
故答案为:18.3;
(2)①N2(g)+3H2(g)=2NH3(g)△H1=a kJ/mol;
②2H2(g)+O2(g)=2H2O(l)△H2=b kJ/mol,
根据盖斯定律可知,目标反应为2×①-3×②,所以2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=(2a-3b)kJ/mol,
故答案为:(2a-3b)kJ/mol;
(3)电解时,N2在阴极上得电子被还原生成氨气,氢离子参加反应,阴极反应式为反应式为N2+6H++6e-=2NH3,
故答案为:反应式为N2+6H++6e-=2NH3;
(4):①分析电离平衡常数可知电离程度,NH3•H2O>H2CO3>HCO3-,对应盐水解程度NH4+<HCO3-<CO32-,常温下0.1mol•L-1的(NH4)2CO3溶液呈碱性,由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),溶液呈碱性;
故答案为:碱;由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液呈碱性;
②A.溶液中铵根离子浓度大于碳酸根离子浓度,碳酸根离子水解程度大于铵根离子水解程度,所以溶液中离子浓度大小为:c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O),故A正确;
B.溶液中存在电荷守恒为:c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故B错误;
C.依据溶液中物料守恒得到:c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1 ,故C正确;
D.依据溶液中物料守恒,n(N):n(C)=2:1,结合溶液中离子种类和守恒关系得到:c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故D正确;
故选:B.
点评 本题考查了反应热的计算、平衡计算、电解质溶液中的离子平衡、电解池电极反应式的书写、盐类水解应用及离子浓度大小比较,中等难度,准确把握化学平衡理论及电解池工作原理、明确电离平衡常数与弱离子水解程度关系是解本题关键,注意守恒思想的灵活运用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ③⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 郑州一中是一所具有丰厚的历史积淀、独特的精神内涵,以关注学生智慧与灵魂为学校文化内核,充满创新精神,能够培养具有国际视野的拔尖人才,拥有核心竞争力的国内名校.目前一中教育集团包含小学部、初中部、高中部三个学部的十余所学校.学校以主体课堂教学为载体,以培养学生的创新思维和实践能力为目标,在教学活动中特别注重学生科学素养的提升,如对于I A和ⅥA族重要元素化合物的性质,各校区根据实际情况开展了丰富多彩的探究活动.
郑州一中是一所具有丰厚的历史积淀、独特的精神内涵,以关注学生智慧与灵魂为学校文化内核,充满创新精神,能够培养具有国际视野的拔尖人才,拥有核心竞争力的国内名校.目前一中教育集团包含小学部、初中部、高中部三个学部的十余所学校.学校以主体课堂教学为载体,以培养学生的创新思维和实践能力为目标,在教学活动中特别注重学生科学素养的提升,如对于I A和ⅥA族重要元素化合物的性质,各校区根据实际情况开展了丰富多彩的探究活动. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强p/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁制品的腐蚀常以析氢腐蚀为主 | |
| B. | 厨房中常用碳酸钠溶液洗涤餐具上的油污 | |
| C. | 明矾[KAl(SO4)2•12H2O]用于水的杀菌消毒 | |
| D. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
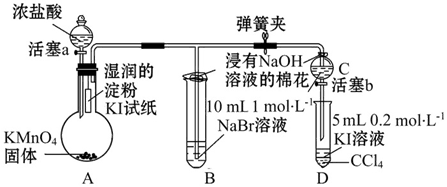
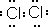 ,在该反应中浓盐酸表现了还原性和酸性.
,在该反应中浓盐酸表现了还原性和酸性.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com