
| A. | 乙烯的实验式:C2H4 | B. | 四氯化碳分子的电子式为: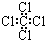 | ||
| C. | 聚丙烯的结构简式为: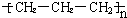 | D. | 异丁烷分子的键线式为: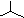 |
分析 A.实验式为分子中各原子的最简比;
B.四氯化碳分子中,Cl原子最外层满足8电子稳定结构;
C.聚丙烯是由丙烯不饱和的碳原子相互加成得到的,链节的主链上含有2个C;
D.异丁烷为2-甲基丙烷,据此判断其键线式.
解答 解:A.C2H4为乙烯的分子式,其实验式为CH2,故A错误;
B.氯原子未成键的孤对电子对未标出,四氯化碳正确的电子式为 ,故B错误;
,故B错误;
C.聚丙烯是由丙烯不饱和的碳原子相互加成得到的,其结构简式为 ,故C错误;
,故C错误;
D.异丁烷是2-甲基丙烷,其键线式为: ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及结构简式、键线式、电子式及实验式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W | Q |
| 原子半径/pm | 160 | 143 | 70 | 66 | 102 |
| 主要化合价 | +2 | +3 | +5、-3 | -2 | +6、-2 |
| A. | X、Y元素的金属性 X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 氢化物的沸点 H2W>H2Q |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
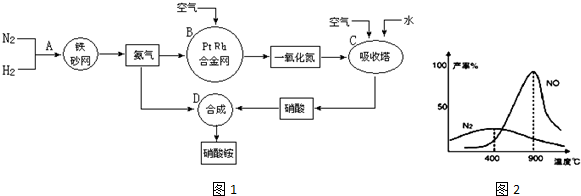
 4NO+6H2O,当温度高于900℃时,NO产率明显下降的原因是生成NO的反应为放热反应,升高温度转化率下降.
4NO+6H2O,当温度高于900℃时,NO产率明显下降的原因是生成NO的反应为放热反应,升高温度转化率下降.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl→CH3COONa溶液:c(Na+)>c(CH3COOH)=c(Cl-) | |
| B. | CO2→NH4HCO3溶液:c(NH4+)═c(HCO3-)+2c(CO32-) | |
| C. | SO2→NaOH溶液:c(Na+)═c(SO32-)+c(HSO3-)+c(H2SO3) | |
| D. | Cl2→NaOH溶液:2c(Cl-)═c(Na+)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
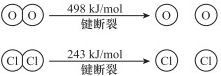
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石和石墨互为同素异形体 | |
| B. | CH3-CH2OH和 CH3-O-CH3互为同分异构体 | |
| C. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | |
| D. | 分子式为C4H10的物质为纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 8min时表示正反应速率等于逆反应速率 | |
| B. | 在0-54分钟的反应过程中该可逆反应的平衡常数始终为4 | |
| C. | 40min时改变的条件是升高温度,且正反应为放热反应 | |
| D. | 反应方程式中的x=1,30min时改变的条件是降低温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com