
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||
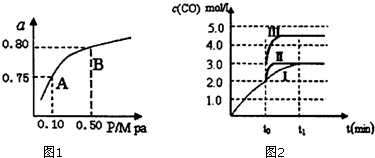
分析 (1)反应②平衡常数随温度升高增大,说明升高温度平衡正向进行,正反应是吸热反应;
(2)平衡常数只受温度影响,不随压强变化;反应①+②可得反应③,则平衡常数K3=K1×K2;
(3)曲线Ⅰ变化为曲线Ⅱ时,缩短反应达到平衡的时间,平衡时CO浓度不变,应是使用催化剂;
当曲线Ⅰ变为曲线Ⅲ时CO浓度增大,反应是气体体积不变的反应,压强不影响平衡移动,可以压缩体积,根据CO的物质的量不变计算压缩后体积;
(4)原电池负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根离子与水.
解答 解:(1)反应②平衡常数随温度升高增大,说明升高温度平衡正向进行,正反应是吸热反应,
故答案为:吸热;
(2)平衡常数只受温度影响,不随压强变化,A、B处于等压线上,故平衡常数(A)=K(B);反应①+②可得反应③,则平衡常数K3=K1×K2,
故答案为:=;K1×K2;
(3)曲线Ⅰ变化为曲线Ⅱ时,缩短反应达到平衡的时间,平衡时CO浓度不变,应是使用催化剂;
当曲线Ⅰ变为曲线Ⅲ时CO浓度增大,反应是气体体积不变的反应,压强不影响平衡移动,可以压缩体积,CO的物质的量不变,压缩后体积为$\frac{3L×3mol/L}{4.5mol/L}$=2L,即将容器的体积(快速)压缩至2L;
故答案为:加入催化剂;将容器的体积(快速)压缩至2L;
(4)原电池负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根离子与水,负极电极反应式为:CH3OH-6 e-+8 OH-=CO32-+6 H2O,
故答案为:CH3OH-6 e-+8 OH-=CO32-+6 H2O.
点评 本题考查化学平衡影响因素、化学平衡常数、化学平衡图象、原电池等,注意对平衡常数表达式的理解掌握,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ①③⑤ | C. | ①②⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O中氧元素的化合价为-l | B. | O2中氧元素的化合价为-2 | ||
| C. | NaOH中氧元素的化合价为-2 | D. | Na2O2中氧元素的化合价为-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. | 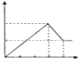 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红的溶液中:Na+、Cl-、CH3COO-、Fe2+ | |
| B. | 水电离的OH-浓度为10-12mol/L-1的溶液中:Mg2+、NH4+、AlO2-、SO32- | |
| C. | 无色溶液中:Al3+、NO3-、Cl-、SO42- | |
| D. | c(H2C2O4)=0.5 mol/L溶液中:Na+、K+、MnO4-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电过程中电解质溶液中阴离子移向正极 | |
| B. | 放电时每转移0.5mol电子,负极有0.5molV2+被氧化 | |
| C. | 充电时阳极附近溶液的酸性减弱 | |
| D. | 充电时阳极反应式为:VO2++2H++e-═VO2++H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com