
| A. | 天然油脂--混合物 | B. | 氯气--非电解质 | ||
| C. | 二氧化氮--酸酐 | D. | 二氯甲烷--非极性分子 |
分析 A.不同物质组成的为混合物;
B.水溶液中和熔融状态都不导电的化合物为非电解质;
C.酸失去一分子水剩余的部分为酸酐,形成酸性的元素化合价不变;
D.四面体结构被压缩,为四面体结构,属于卤代烃,分子中正负电荷重心不重合;
解答 解:A.天然油脂是有不同的高级脂肪酸与甘油形成的酯,大多是由混甘油酯分子构成的混合物,故A正确;
B.氯气是单质不是化合物,既不是电解质也不是非电解质,故B错误;
C.二氧化氮中N元素化合价为+5价,硝酸中N元素化合价为+5价,化合价不相等,则二氧化氮不是硝酸的酸酐,硝酸的酸酐为五氧化二氮,故C错误;
D.二氯甲烷为四面体结构,但氯原子和氢原子大小不同,C-H、C-Cl键长不同,分子中正负电荷重心不重合,为极性分子,故D错误;
故选A.
点评 本题考查了物质分类、分子极性、电解质和非电解质的概念分析、酸酐的判断方法,注意知识的积累,题目较简单.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 醋酸和碳酸钙反应:2H++CO32-═H2O+CO2↑ | |
| B. | 锌片插入硝酸根溶液中:Zn+Ag+═Zn2++Ag | |
| C. | 铜和稀硝酸反应:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O | |
| D. | 氯气和氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/K | 反应I | 反应II | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
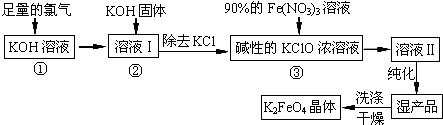

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 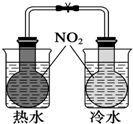 证明温度对平衡移动的影响 | B. | 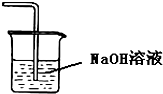 吸收HCl尾气 | ||
| C. | 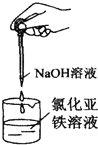 制备氢氧化亚铁 | D. | 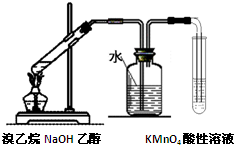 验证溴乙烷消去反应生成了乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 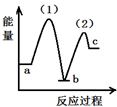 | B. | 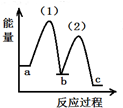 | C. | 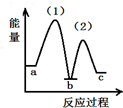 | D. | 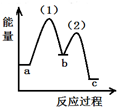 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
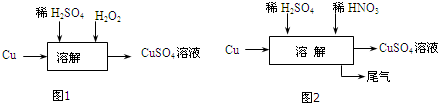
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应,熵增加 | B. | 放热反应,熵减小 | C. | 吸热反应,熵增加 | D. | 吸热反应,熵减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com