
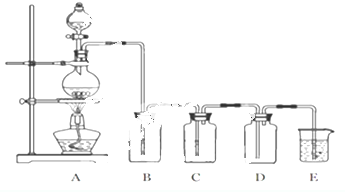
分析 (1)实验室用加热浓盐酸与二氧化锰反应制取氯气,浓盐酸具有挥发性,所以制备的氯气中含有氯化氢和水蒸气,要得到干燥的氯气,应依次通过盛有饱和食盐水、浓硫酸的洗气瓶,分别去掉氯化氢和水;
(2)碳和浓硫酸加热反应生成二氧化碳、二氧化硫和水蒸气;
①D装置中品红溶液的作用是验证二氧化硫是否被高锰酸钾溶液完全吸收,D装置中品红不褪色,装置E澄清石灰水变浑浊说明生成二氧化碳;
②若证明SO2具有氧化性,通过Na2S溶液验证,同时证明碳酸的酸性比硅酸的强,是除净二氧化硫的二氧化碳气体通过硅酸钠溶液生成白色沉淀证明.
解答 解:(1)装置A中二氧化锰与浓盐酸加热生成氯气、氯化锰和水,方程式:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;浓盐酸具有挥发性,所以制备的氯气中含有氯化氢和水蒸气,要得到干燥的氯气,应依次通过盛有饱和食盐水B、浓硫酸的C洗气瓶,分别去掉氯化氢和水,所以C瓶作用为干燥氯气;
故答案为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O; 干燥Cl2;
(2)碳和浓硫酸加热反应生成二氧化碳、二氧化硫和水蒸气,C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+SO2↑+2H2O,
①装置B、C、D、E中分别装有品红溶液、酸性KMnO4溶液、品红溶液、澄清石灰水,则D装置中品红溶液的作用是验证二氧化硫是否被高锰酸钾溶液完全吸收,证明气体中有CO2的现象是D装置中品红不退色,E装置中有白色沉淀,
故答案为:验证SO2是否除净;D装置中品红不退色,E装置中有白色沉淀;
②若证明SO2具有氧化性,通过装置B中的Na2S溶液验证,二氧化硫和硫化钠反应生成硫单质,溶液中变浑浊,证明碳酸的酸性比硅酸的强,是通过高锰酸钾溶液除去二氧化硫后,再通过品红溶液检验二氧化硫是否除净,把气体通过硅酸钠溶液生成白色沉淀证明碳酸的酸性比硅酸的强;
故答案为:有黄色沉淀(或黄色浑浊);Na2SiO3;
点评 本题为实验题,考查了物质的制备、性质的检验,侧重考查实验操作、分析能力,明确氯气实验室制备原理,二氧化硫的性质是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 5 9 6 | B. | 5 6 6 | C. | 3 9 7 | D. | 4 6 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | d元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | 只有a与题中其他元素生成的化合物都是离子化合物 | |
| D. | c、d形成的气态氢化物的还原性:d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
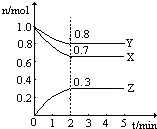 某温度时,在一个2L恒容的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L恒容的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水中加少量碳酸氢钠:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2↑ | |
| D. | 碳酸钠的水解反应:CO32+H3O+?HCO3-+H2O3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
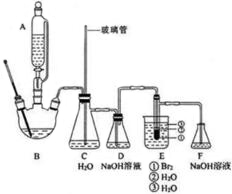 1,2-二溴乙烷是常用的有机合成中间体,某小组用如下装置合成1,2-二溴乙烷.
1,2-二溴乙烷是常用的有机合成中间体,某小组用如下装置合成1,2-二溴乙烷.| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 1,2-二溴乙烷 | 131.4 | 2.18 | 微溶 |
| 溴 | 58.8 | 3.12 | 微溶 |
| 乙醇 | 78.5 | 0.79 | 溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,3-二甲基丁烷 | B. | 3,3-二甲基丁烷 | ||
| C. | 2-甲基-3-乙基戊烷 | D. | 2,2,3,3-四甲基丁烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com