
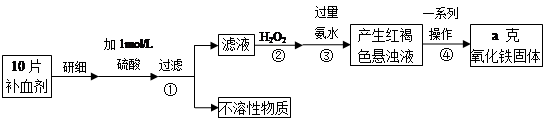


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源:不详 题型:单选题
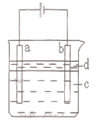
| A.a电极发生的电极反应:4OH--4e-=O2↑+2H2O |
| B.为了在较短时间内看到白色沉淀,可适当加大电压 |
| C.c可以是氯化钠溶液,d可以是苯 |
| D.为了在较短时间内看到白色沉淀,可以剧烈地搅拌溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铁恰好将Fe3+全部还原 |
| B.往反应后溶液中滴入KSCN溶液,不显红色 |
| C.溶液变为浅绿色 |
| D.Fe2+和Fe3+物质的量之比为6:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
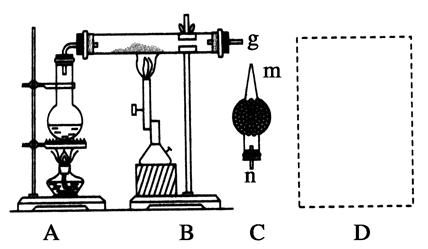
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| A.Na2SO3溶液与HNO3 | B.Na2SO3固体与浓硫酸 |
| C.固体硫在纯氧中燃烧 | D.铜与热浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu2+ | B.Fe 2+、Fe3+ | C.Fe 3+、Cu2+ | D.Fe 2+、Cu2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
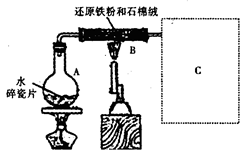
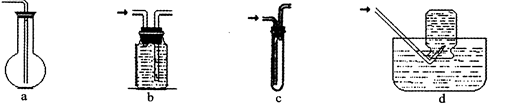
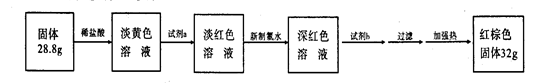
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实 验 | 预 测 |
| A | 蒸发FeCl3溶液 | 得到FeCl3固体 |
| B | 在FeCl3、CuCl2混合液中,加入少量Fe粉 | 一定有H2产生且有Cu析出 |
| C | 用FeCl3固体溶于水配制饱和溶液 | 会有Fe(OH)3沉淀产生 |
| D | 在FeCl3溶液中,加入KHCO3溶液 | 有CO2产生,但无Fe(OH)3沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com