
【题目】下列图像表示向AlCl3溶液中滴加NaOH溶液的过程中或向NaAlO2溶液中滴加稀盐酸的过程中Al3+与![]() 物质的量的变化曲线,实线表示Al3+物质的量的变化,虚线表示
物质的量的变化曲线,实线表示Al3+物质的量的变化,虚线表示![]() 物质的量的变化。其中正确的是( )
物质的量的变化。其中正确的是( )
A.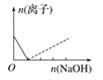 B.
B.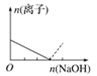 C.
C.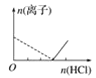 D.
D.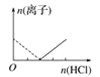
【答案】B
【解析】
向AlCl3溶液中滴加NaOH溶液的过程中,发生反应分别为:Al3++3OH-═Al(OH)3↓、OH-+Al(OH)3=AlO2-+2H2O;NaAlO2溶液中滴加稀盐酸的过程中Al3+与AlO2-的过程中发生的反应分别为:AlO2-+H++H2O═Al(OH)3↓、Al(OH)3+3H+═Al3++3H2O,据此进行判断。
向AlCl3溶液中滴加NaOH溶液的过程中,发生反应分别为:Al3++3OH-═Al(OH)3↓、OH-+Al(OH)3=AlO2-+2H2O,根据反应可知,Al3+完全沉淀所消耗的NaOH的物质的量与沉淀溶解生成AlO2的物质的量达到最大值所消耗NaOH的物质的量之比为3:1,满足条件的图象为B,即A错误、B正确;
NaAlO2溶液中滴加稀盐酸的过程中Al3+与AlO2的过程中发生的反应分别为:AlO2-+H++H2O═Al(OH)3↓、Al(OH)3+3H+═Al3++3H2O,则偏铝酸根离子完全沉淀所消耗的HCl的物质的量与沉淀溶解生成铝离子的物质的量达到最大值所消耗的HCl的物质的量之比为1:3,C中为3:1,D中为1:1,故C、D均是错误的。
答案选B。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】在一定温度、压强下,向密闭容器中投入一定量N2和H2,发生反应:N2+3H2![]() 2NH3 △H<0。
2NH3 △H<0。
(1)反应开始阶段,v(正)_______(填“>”“<”或“=”)v(逆),随后v(正)________逐渐(填“增大”或“减小”,下同),v(逆)逐渐_______,反应达到平衡时,v(正)_______(填“>”“<”或“=”)v(逆)。
(2)达到平衡后,若正反应速率用v(N2)表示,逆反应速率用v’(H2)表示,则v(N2)=____v’(H2)。
(3)下列措施中能加快反应速率并提高氢气的转化率的是_______(填字母)。
A 其他条件不变时,压缩容器体积 B 其他条件不变时,升高反应体系温度
C 使用合适的催化剂 D 保持容器体积不变,充入一定量的氮气
(4)实际生产中往往需要将温度控制在一个合适的范围,分析温度不宜过高也不宜过低的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有0.01 mol Cu,a mol Cu2O、b mol CuO的混合物中滴加6 mol·L-1的稀硝酸溶液至10ml时,固体恰好完全溶解,得到标准状况下224mL气体(纯净物)。下列说法正确的是
A.反应过程中转移0.01 mol电子B.a:b=1:1
C.被还原的硝酸为0.06 molD.将少量铁粉投入该稀硝酸中能生成Fe(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年11月30日,国际纯粹与应用化学联合会(IUPAC)公布了118号元素符号为Og,至此元素周期表的七个周期均已填满。下列关于![]() 的说法错误的是
的说法错误的是
A. 原子序数为118 B. 中子数为179
C. 核外电子数为118 D. Og的相对原子质量为297
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将燃煤排放的含有SO2的烟气通入海水(主要含Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子)进行脱硫的工艺流程如图所示,下列说法中正确的是( )
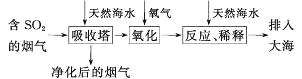
A. 天然海水显酸性
B. 氧化过程中可能发生的离子反应为2SO2+2H2O+O2=4H++2SO42-
C. 排入大海的溶液与天然海水相比,只有SO42-数量发生了变化
D. 若将氧化后的液体进行蒸发结晶,得到的晶体中CaSO4含量最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20mL浓度均为0.1mo1/L的MOH和NH3·H2O混合液中滴加0.1mol的CH3COOH溶液,测得混合液的电阻率(表示电阻特性的物理量)与加入CH3COOH溶液的体积(V)的关系如图所示。已知CH3COOH的Ka=1.8×10-5,NH3·H2O的Kb=1.8×10-5。下列说法错误的是( )
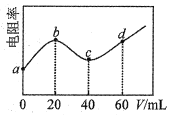
A.MOH是强碱
B.c点溶液中浓度:c(CH3COOH)<c(NH3·H2O)
C.d点溶液呈酸性
D.a→d过程中水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题(Cl2易溶于CCl4)。
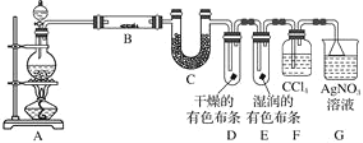
(1)若用含有7.3 g HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2质量总是小于3.55 g的原因是________________________________。
(2)①装置B中盛放的试剂名称为________________,作用是________________________________,现象是_____________________________。
②装置D和E中出现的不同现象说明的问题是___________________。
③装置F的作用是__________________________________________。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在________与________之间(填装置字母序号),装置中应放入________(填写试剂或用品名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的短周期主族元素。X分别与Y、Z、W结合形成质子数相同的甲、乙、丙三种分子。丁为无色气体,遇空气变红棕色;丙的水溶液可刻蚀玻璃。上述物质有如图转化关系:下列说法正确的是( )
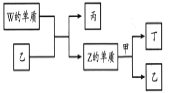
A.甲、乙、丙中沸点最高的是甲
B.甲常用作制冷剂
C.四种元素形成的单质中W的氧化性最弱
D.四种元素原子半径大小:W > Z > Y > X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铝镁[MgaAlb(OH)c(CO3)d]在一定条件下的转化如下图所示,下列说法正确的是
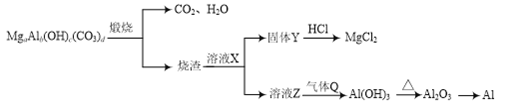
A. a、b、c、d符合关系式:2a+3b=c+2d
B. X可能为NaOH
C. Q可能为NH3
D. 工业上用CO还原Al2O3的方法制取金属Al
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com