
分析 (1)过氧化氢在二氧化锰作催化剂的条件下生成水和氧气;
(2)H2O2与I-反应生成I2和H2O;
(3)①高锰酸钾溶液具有强氧化性,需要装在酸式滴定管中,滴定终点利用高锰酸钾溶液呈紫红色做指示剂指示到终点;
②依据氧化还原得失电子守恒配平.
解答 解:(1)过氧化氢在二氧化锰作催化剂的条件下生成水和氧气,双氧水分解的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$ 2H2O+O2↑;故答案为:2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;(2)H2O2具有强氧化性能I-氧化为I2同时生成H2O,其反应的离子方程式为:H2O2+2I-+2H+═2H2O+I2;故答案为:H2O2+2I-+2H+═2H2O+I2;
(3)①高锰酸钾溶液具有强氧化性,需要装在酸式滴定管中,滴定终点利用高锰酸钾溶液呈紫红色做指示剂指示到终点;
故答案为:酸式; 滴入一滴酸性KMnO4溶液后变紫色,30s不褪色;
②氧化还原反应:MnO4-+H2O2+H+-Mn2++O2↑+H2O中,Mn的化合价从+7降低为+2价,降低了5价,O的化合价从-1价升高到了0价,两个氧原子一共升高了2价,所以Mn元素的前边系数是2,双氧水的前边系数是5,根据电荷守恒和原子守恒,得到反应为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,反应转移电子是10mol,若反应中生成1mol氧气,转移电子数是2mol电子,故答案为:2、5、6 2、5、8 H2O;还原剂;2.
点评 本题主要考查的是双氧水的性质,涉及双氧水的氧化性和还原性,氧化还原反应方程式的配平,得失电子的计算等,综合性较强,有一定难度.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.2mol/(L•min) | B. | 6.0mol/(L•min) | C. | 0.6mol/(L•min) | D. | 0.4mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 | |
| B. | NH4HSO4溶液中滴加NaOH溶液至pH=7,则c(Na+)=2c(SO42-) | |
| C. | 0.1 mol•L-1CH3COOH溶液与0.1 mol•L-1CH3COONa等体积混合后pH<7,则c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | KNO3和CH3COONH4溶液pH均为7,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
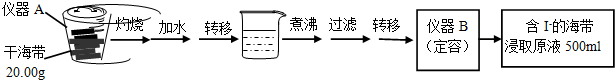
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
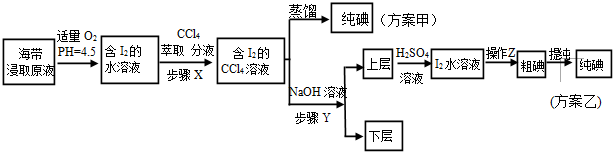
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO4溶液中滴加Ba(OH)2溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 向饱和Na2CO3溶液中通入足量CO2:2Na++CO32-+CO2+H2O═2NaHCO3↓ | |
| C. | 向Ca(HCO3)2溶液中加入足量Ca(OH)2溶液:Ca2++HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 向次氯酸溶液中滴加NaOH溶液:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
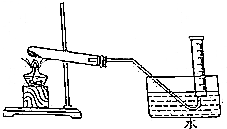 为验证MnO2在KClO3受热分解制O2的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:
为验证MnO2在KClO3受热分解制O2的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
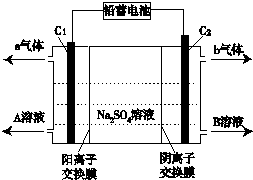
| A. | C1极电极与铅蓄电池的Pb电极相接,C2极与铅蓄电池的PbO2电极相接 | |
| B. | 当C1极产生标准状况下11.2 L气体时,铅蓄电池的负极增重64g | |
| C. | A溶液为氢氧化钠溶液,B溶液为硫酸 | |
| D. | 该电解反应的总方程式可以表示为:2Na2SO4+6H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+4NaOH+O2↑+2H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com